 05.10.2024
05.10.2024
Современные методы визуализации в диагностике стадировании и выработке тактики лечения первичных злокачественных опухолей костей
Саркомы костей представляют собой редкую и гетерогенную группу новообразований, которые составляют менее 1% от всех злокачественных опухолей человека
Саркомы костей представляют собой редкую и гетерогенную группу новообразований, которые составляют менее 1% от всех злокачественных опухолей человека. Саркомы высокой степени злокачественности (G3-G4), к которым относятся большинство остеосарком, саркома Юинга, низкодифференцированные хондросаркомы, недифференцированная плеоморфная саркома, отличаются склонностью к ранней гематогенной диссеминации и требуют комбинированных лечебных подходов. Помимо воздействия на первичную опухоль, необходима многокомпонентная химиотерапия, направленная на микрометастазы. У пациентов с IV стадией заболевания локальному лечению должны подвергаться все выявленные на диагностическом этапе отдаленные метастазы.В данной статье представлены возможности современных технологий медицинской визуализации на основных этапах ведения пациентов с саркомами костей высокой степени злокачественности. В первой части речь пойдет о диагностике, установлении стадии и предоперационной химиотерапии.
Во второй части будут обсуждены этап планирования локального лечения первичной опухоли и метастазов, а также период наблюдения после окончания лечения.
Сегодня в арсенале онкологов имеется довольно широкий спектр методов, которые позволяют оценить не только структурные, но и функциональные характеристики опухоли (см. таблицу), что обеспечивает точную диагностику, стадирование и мониторинг заболевания.
Диагностика.
Правильно установленный диагноз во многом определяет успех лечения новообразований костей. Диагностика сарком — это коллективный труд, в котором принимают участие онкологи, специалисты инструментальной диагностики и патологоанатомы. Семиотика новообразований скелета хорошо описана в литературе, поэтому остановимся собственно на алгоритме обследования.
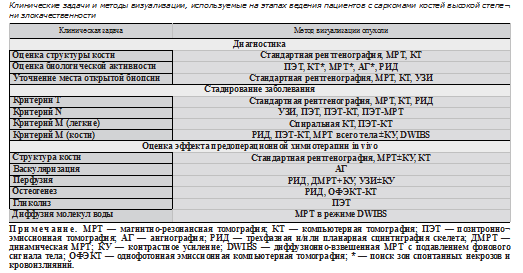
В соответствии с современными рекомендациями при подозрении на опухоль кости обследование начинается со стандартной рентгенографии в двух проекциях. Если диагноз опухоли по данным рентгенографии установить не удается, но подозрения остаются, выполняется МРТ. При сохранении диагностических трудностей для лучшей визуализации костеобразования, периостальной реакции, состояния коркового слоя показана КТ. Обязательным этапом диагностики является биопсия опухоли.
В ряде стран, например в США, у пациентов старше 40 лет, обследование направлено в первую очередь на исключение метастатической природы изменений скелета. Если после комплексного обследования доказана солитарность поражения, процесс трактуется как первичная опухоль и выполняется биопсия.
Даже самые современные методы структурной и функциональной визуализации (гибридные технологии), как, например, ПЭТ-КТ, не могут заменить биопсию, поскольку активные метаболические процессы могут наблюдаться в доброкачественных новообразованиях, при псевдоопухолевых заболеваниях и в очагах воспаления [1]. С другой стороны, низкие и умеренно повышенные уровни гликолиза наблюдаются в ряде высокодифференцированных сарком [1, 2]. Предпринимались попытки повысить диагностическую точность ПЭТ путем регистрации поздних (более 2 ч) уровней гликолиза. Поскольку в саркомах глюкоза выводится медленнее, удалось повысить специфичность метода с 44 до 76% [3]. В целом чувствительность ПЭТ-КТ при дифференциальной диагностике доброкачественных процессов и сарком костей высока и составляет около 95%, в то время как специфичность не превышает 80% [4].
Оценка биологической активности. С целью адаптации тактики лечения к степени риска предпринимались попытки поиска морфологических и функциональных критериев, которые коррелировали бы со степенью злокачественности, позволяли бы предсказать ответ на химиотерапию и прогноз.
При остеосаркоме клинические, рентгенологические, ангиографические и сцинтиграфические (перфузия и остеогенез) критерии продемонстрировали низкую информативность в плане оценки и прогнозирования агрессивности течения [5]. В большей степени с прогнозом коррелировали темп роста опухоли (соотношение объема к длительности анамнеза), а также видимые при КТ, МРТ или ангиографии косвенные признаки спонтанных некрозов и кровоизлияний во внекостном компоненте.
В отдельных работах изучалась прогностическая роль уровня гликолиза при саркомах костей, однако данные об информативности ПЭТ или ПЭТ-КТ оказались противоречивыми [6-10].
Таким образом, в настоящее время ни один метод визуализации не используется для изначальной стратификации (выделение групп риска) больных с саркомами костей.
Уточнение места биопсии. При планировании биопсии учитываются два основных фактора: наиболее короткий путь до новообразования и будущий хирургический доступ при выполнении резекции кости. Стандартная рентгенография чаще всего дает полную информацию об оптимальном месте биопсии, однако в ряде случаев требуется дополнительная визуализация, в частности при сложных анатомических локализациях, для выявления зон максимальной метаболической активности, а также для того, чтобы избежать очагов спонтанного некроза, выраженного склероза или гиперваскулярных участков. С этой целью могут использоваться УЗИ, КТ (строго по показаниям с учетом лучевой нагрузки, особенно в детском возрасте), ПЭТ-КТ [11] и МРТ.
Стадирование. Для стадирования первичных опухолей костей используются классификация TNM с указанием степени злокачественности (G), а также хирургическая классификация [12].
Т-стадирование. Основная цель хирургического этапа — радикальное удаление первичной опухоли. С целью определения местной распространенности, уровня резекции, планирования реконструктивного этапа и изготовления индивидуального эндопротеза используют стандартную рентгенографию, КТ, МРТ и РИД. Методом выбора для оценки распространенности по костномозговому каналу, выявления skip-метастазов, вовлечения эпифизарной пластинки, а также сосудисто-нервных образований считается МРТ. Метод также дает информацию о поражении элементов сустава и тем самым позволяет принять решение о виде резекции — вне- или внутрисуставной.
N-стадирование. Для оценки состояния регионарных лимфоузлов используют УЗИ, ПЭТ и гибридные технологии — ПЭТ-КТ, ПЭТ-МРТ [13].
М-стадирование. Клиническое значение дотерапевтического выявления отдаленных метастазов при саркомах костей больше обусловлено необходимостью их последующего мониторинга и лечения. В меньшей степени сегодня М-стадирование влияет на выбор режима предоперационной химиотерапии, поскольку несмотря на худший прогноз при М1, адаптация режима к стадии широко не применяется. В отдельных клиниках при саркоме Юинга проводится более агрессивная, чем при М0, индукционная химиотерапия [14]. Согласно же большинству современных протоколов пациенты получают предоперационную химиотерапию независимо от стадии. Выделение групп риска и изменение режима лечения происходит, как правило, после операции.
С учетом вышесказанного, клиническая роль М-стадирования представляется более важной в контексте выявления и количественной оценки всех метастатических очагов с целью их мониторинга, правильной интерпретации эффекта химиотерапии и планирования их локального лечения.
Саркомы костей метастазируют преимущественно в легкие. Методом выбора в диагностике легочных метастазов остается спиральная КТ, которая позволяет выявить больше очагов, чем стандартная рентгенография. Особенно это касается мелких (<5 мм) и некальцинированных образований. Компьютерная томография с контрастированием позволяет точнее оценить состояние лимфатических узлов средостения, плевры, костей грудной клетки и верхних отделов брюшной полости.
Позитронно-эмисионная томография, в силу низкой разрешающей способности, уступает по информативности спиральной КТ [4, 14, 15]. В то же время ПЭТ-КТ показала высокую чувствительность и специфичность за счет лучшей визуализации с помощью КТ и возможности оценить метаболизм, что позволяет провести дифференциальный диагноз с доброкачественными очагами [16]. Некоторые диагностические сложности возникают при ПЭТ-КТ визуализации очагов размером до 1 см [16-18]. В небольшом очаге отсутствие сигнала на ПЭТ не исключает наличия в нем метастатических клеток. Мета-анализ показал, что чувствительность и специфичность ПЭТ-КТ при выявлении легочных метастазов составили 88 и 98% соответственно [4]. В настоящее время эта гибридная методика не используется рутинно для выявления метастазов в легких при саркомах костей [11].
Второй по частоте локализацией отдаленных метастазов является скелет. Радиоизотопное исследование костной системы основано на способности фосфатных соединений, меченных технецием (99mTc), накапливаться в участках с высокой остео- бластической активностью (зоны первичного или реактивного остеогенеза). Этот метод является наиболее дешевым и доступным и включен в алгоритм обследования больных с саркомами костей. По данным литературы его чувствительность варьирует в пределах от 60 до 90% [14, 19, 20]. Остеобластический ответ не всегда является самым ранним проявлением опухолевого роста, особенно при низком уровне костеобразования, поэтому бывают ложноотрицательные заключения. Недостатком метода считается необходимость рентгенконтроля очагов гиперфиксации, однако ОФЭКТ-КТ решает проблему. Некоторые сложности с интерпретацией возникают при метастазах в позвоночнике [20] и у детей, у которых физиологически уровень остеогенеза в зонах роста повышен [19].
Другим методом системного обследования является ПЭТ. При остеосаркоме этот метод не обладает большими преимуществами перед сцинтиграфией при выявлении костных метастазов. В то же время при саркоме Юинга, при которой остеогенез не всегда выражен, ПЭТ дает больше диагностической информации [14]. В силу высокой информативности ПЭТ может заменить биопсию костного мозга при саркоме Юинга [21].
Гибридные технологии, сочетающие в себе высокую чувствительность уровня метаболической активности и высокую специфичность структурной визуализации, повышают возможности стадирова- ния сарком костей. Чувствительность и специфичность ПЭТ-КТ в выявлении костных метастазов составляет 92 и 98% соответственно [4, 19], поэтому в перспективе сцинтиграфия скелета может отойти на второй план.
Относительно высокая лучевая нагрузка при рентгеновских исследованиях и риск развития вторичных опухолей стимулировали внедрение таких неионизирующих технологий, как МРТ всего тела [20] и диффузионно-взвешенная МРТ [22]. Они позволяют визуализировать очаги опухолевой инфильтрации костного мозга на самых ранних стадиях, до появления остеобластического ответа, определяемого на остеосцинтиграфии, и до наступления рентгенологически, включая КТ, видимых структурных изменений кости.
Магнитно-резонансная томография всего тела считается информативным скрининговым методом выявления отдаленных и skip-метастазов при остеосаркоме, опухолях семейства саркомы Юинга, гистиоцитозе Х (лангергансоклеточный) у детей и обладает преимуществами по сравнению со сцин- тиграфией скелета [23].
За счет усовершенствования МРТ преодолеваются такие недостатки метода, как длительность исследования (45-60 мин), сложности визуализации метастазов в мелких костях, а также недостаточная информативность у детей, у которых физиологически высока насыщенность клетками костного мозга [20].
Диффузионно-взвешенная МРТ всего тела с контрастированием оксидом железа не уступала по информативности ПЭТ-КТ, при этом токсичности контраста не отмечено, а радиация была равна нулю, что особенно важно у детей [22].
Диффузия молекул воды через ткани — еще один критерий для качественной и количественной характеристики опухоли. Это пассивный процесс, на который влияют такие препятствия и ограничения, как клеточные мембраны, а также количество воды, вязкость внеклеточного пространства, наличие некроза. Метод диффузионно-взвешенной МРТ с подавлением фонового сигнала тела, или режим DWIBS (diffusion-weighted whole-body imaging with background body signal suppression), основан на получении изображений с учетом диффузии молекул воды через ткани. В опухолевой ткани уровень пролиферации и клеточность высоки, поэтому свободная диффузия молекул воды затруднена. Это позволяет дифференцировать активную опухоль от бесклеточных и некротических участков. С помощью МРТ в режиме DWIBS удается визуализировать 92% опухолевых очагов, видимых при ПЭТ-КТ [24]. Для повышения диагностической точности всегда необходимо выполнение МРТ-контроля, например в режиме STIR, которое позволит избежать ложноположительных результатов при доброкачественных процессах и ложноотрицательных — при склеротических метастазах. Методика не зависит от движений пациента, т.е. он может свободно дышать во время исследования. Роль МРТ всего тела в режиме DWIBS активно изучается при различных злокачественных новообразованиях [25-28], однако больших исследований, касающихся сарком костей, пока нет. В ЦИТО им. Н.Н. Приорова в настоящее время идет набор клинического материала по этой теме.
Таким образом, имеющиеся на сегодняшний день методы медицинской визуализации позволяют с высокой точностью оценить степень местной распространенности, выявить регионарные и отдаленные метастазы сарком костей. Алгоритм обследования во многом зависит от возможностей и оснащенности конкретной клиники, а также от решаемых в ней научно-практических задач.
Оценка эффекта химиотерапии in vivo. В специализированных центрах пациенты с саркомами костей высокой степени злокачественности, как правило, включаются в протоколы и получают фиксированное количество курсов химиотерапии до и после операции [29]. Однако в некоторых клиниках и исследовательских группах, в рамках индивидуализированных подходов, схема и длительность индукционной химиотерапии адаптируются к ответу, который оценивается еще на дооперационном этапе, т.е. in vivo [9, 14, 30-32]. В случае отсутствия эффекта рассматриваются альтернативные режимы или выполняется операция. При выраженном ответе продолжение химиотерапии направлено на достижение максимального эффекта и улучшение условий для радикальной резекции. Ответадаптированный подход к неоадъювантной химиотерапии показал свою эффективность и при других злокачественных опухолях [33-36].
В этом контексте возрастает роль различных методов дооперационной оценки ответа. Используемые при солидных опухолях критерии эффективности, например RECIST, где учитываются размеры и количество очагов, при саркомах костей неинформативны. Сегодня онколог имеет возможность наблюдать и контролировать в процессе химиотерапии целый ряд характеристик опухоли. Помимо оценки клинического ответа, современная медицинская визуализация позволяет рассчитать объем новообразования, оценить пери- туморальный отек, увидеть рентгенологическую репарацию кости, оценить васкуляризацию, перфузию, тканевую диффузию молекул воды, интенсивность различных звеньев метаболизма и др.
Сегодня без особых проблем можно увидеть отсутствие эффекта или прогрессирование. Намного сложнее предсказать IV степень лечебного пато- морфоза (некроз 100%), что важно учитывать при планировании органосохраняющего локального лечения, например экономных резекций или лучевой терапии.
На стандартной рентгенограмме положительная динамика характеризуется уменьшением размеров опухоли, отграничением внекостного компонента от внескелетных тканей, ассимиляцией периостальной реакции (рис. 1).
Лучше структурные изменения можно увидеть с помощью КТ, которая позволяет визуализировать отграничение литических очагов и формирование ячеисто-трабекулярных структур во внекостном компоненте, его более четкое отграничение (рис. 2). Точнее размеры и объем опухоли в динамике можно проследить с помощью МРТ (рис. 3).
Состояние сосудистой сети — важный критерий ответа при саркомах костей. По данным ангиографии уже после двух курсов химиотерапии возможна качественная и полуколичественная оценка эффекта. На этом этапе ангиографическим
Низкая чувствительность обусловлена большим процентом ложноотрицательных ответов, когда, несмотря на остаточную патологическую васкуляризацию, выявлялся выраженный лечебный патоморфоз.
Перфузия — активный процесс прохождения крови через ткани, который зависит от микрососудистой плотности, проницаемости эндотелия, объема и скорости локального кровотока. По уровню перфузии косвенно можно судить о степени некроза опухоли. Количественную оценку процесса
Гистологическое заключение: лечебный пато- морфоз III степени (некроз опухоли более 90%).
можно получить с помощью так называемых пер- фузионно чувствительных методик: трехфазной сцинтиграфии, МРТ с контрастным
усилением, УЗИ-доплерографии или динамического УЗИ с контрастированием [37].
Трехфазная сцинтиграфия позволяет оценить динамику прохождения по сосудистой сети новообразования меченых фосфатных соединений. При эффективном лечении наступает резкое снижение или нормализация уровня накопления изотопа в сосудистой фазе (рис. 6).
Уже на ранних этапах химиотерапии прослеживаются тенденции, которые свидетельствуют о том, что выраженный лечебный патоморфоз достоверно ассоциируется со снижением уровня перфузии опухоли [5]. В то же время низкие показатели перфузии не являются ни достаточным, ни необходимым условием достижения выраженного некроза опухоли, что ограничивает диагностическую точность критерия.
Динамическая МРТ с контрастированием позволяет дифференцировать некротические ткани и зоны отека от жизнеспособной опухоли. В зоны некроза контраст не поступает и кривая имеет плоский вид, в то время как в неповрежденной опухоли наблюдается резкое накопление контраста в сосудистой фазе (1-2 мин исследования; рис. 7). Современные технологии и программное обеспечение позволяют провести полное МРТ- картирование опухоли и изучить кривые накопления вплоть до отдельных пикселей (pixel-by-pixel).
Точность предсказания гистологического ответа при остеосаркоме с помощью данной методики составляет около 90%, чувствительность — 80-85%, специфичность — 90-100% [38, 39].
Гибель опухолевых клеток на фоне лечения, разрушение их клеточной мембраны облегчает процесс диффузии молекул воды, что отражается на интенсивности диффузионно-взвешенного сигнала при проведении МРТ [40]. В настоящее время в ЦИТО им. Н.Н. Приорова изучается информативность МРТ (режим DWIBS) в оценке эффекта предоперационной химиотерапии при саркомах костей (рис. 8).
Метаболический ответ. Некроз опухоли часто сопровождается выраженным снижением или нормализацией уровня остеобластической активности (рис. 6) [5] и гликолиза. В ПЭТ-диагностике используются ряд количественных параметров: SUV1 и SUV2 — поглощение глюкозы до и по окончании химиотерапии соответственно; соотношение SUV2:1, относительное снижение — (SUV1-SUV2)/SUV1. Чаще учитывают SUVmax — участки с максимальным уровнем гликолиза [9, 10, 41]. Внедрение ПЭТ-КТ улучшило визуализацию патологических очагов и дало возможность оценить общий уровня гликолиза (TLG) и метаболический объем (MTV) опухоли.
Динамика показателей уровня метаболизма глюкозы на фоне химиотерапии коррелирует с гистологическим ответом при остеосаркоме [7, 9, 10] и саркоме Юинга [42]. Чувствительность и специфичность SUV2 (порог 2,5) составили 75 и 78% соответственно. Более информативным было соотношение SUV2:1 (порог 0,5), чувствительность и специфичность которого составили 83 и 88% соответственно.
Метаболический ответ коррелирует с прогнозом при остеосаркоме [9, 43, 44] и саркоме Юинга [42, 45], хотя прогностическая информативность ПЭТ-критериев неоднозначна. Полной нормализации SUV2 не происходит, поскольку в опухоли остаются метаболически активные зоны воспаления и реактивные процессы. В работе D. Hawkins и соавт. [9] только SUV2 (порог 2,5) был достоверно связан с выживаемостью, при этом ни соотношение SUV2:1, ни лечебный патоморфоз не влияли на прогноз. В другом исследовании наличие после химиотерапии остаточных участков с высокой метаболической активностью (SUV2max) также коррелировало с неблагоприятным исходом [43].
Сочетание ПЭТ-КТ-критериев с объемом опухоли [46] позволяет количественно оценить эффект химиотерапии [1], причем уже на ранних этапах лечения [46, 47]. Двухфазная ПЭТ-КТ, которая регистрирует картину на 60-й и 150-й минуте после введения меченой глюкозы, повышает предсказательную точность методики [48].
Предсказание патоморфоза и прогноза с помощью ПЭТ зависит от морфологии опухоли [49, 50]. При остеосаркоме снижение уровня гликолиза более чем на 50% дает основание надеяться на выраженный ответ, в то время как при саркоме Юинга только значительное (>90%) снижение предопределяет лечебный патоморфоз III-IV степени [50].
Таким образом, современные технологии медицинской визуализации позволяют проводить мониторинг предоперационной химиотерапии in vivo. Ранняя оценка эффекта может способствовать принятию тактических решений уже на предоперационном этапе и более широкому внедрению ответа- даптированных режимов лечения сарком костей.
В заключение отметим, что диагностикой, стади- рованием и комбинированным лечением пациентов с саркомами костей высокой степени злокачественности должны заниматься специализированные центры, владеющие стандартами диагностики, ста- дирования, лечения и мониторинга на основе современных технологий медицинской визуализации.
ЛИТЕРАТУРА
2. Costelloe C.M., Chuang H.H., Madewell J.E. FDG PET/CT of primary bone tumors. AJR Am. J. Roentgenol. 2014; 202 (6): W521-31.
3. Tian R., Su M., Tian Y., Li F, Li L, Kuang A., Zeng J. Dual-time point PET/CT with F-18 FDG for the differentiation of malignant and benign bone lesions. Skeletal Radiol. 2009; 38 (5): 451-8.
4. Liu F., Zhang Q., Zhu D., Li Z., Li J., Wang B. et al. Performance Of Positron Emission Tomography and Positron Emission Tomography/Computed Tomography Using Fluorine-18-Fluorodeoxy glucose For The Diagnosis, Staging, and Recurrence Assessment of Bone Sarcoma: A Systematic Review and Meta-Analysis. Medicine (Baltimore). 2015; 94 (36): e1462.
5. Мачак Г.Н. Современные возможности и перспективы комбинированного лечения остеосаркомы: Дис. ... д-ра мед. наук. М.; 2007 [Machak G.N. Modern potentialities and perspectives of sarcoma combined treatment. Dr. med. sci. Diss. Moscow; 2007 (in Russian)].
6. Andersen K.F., Fuglo H.M., Rasmussen S.H., Petersen M.M., Loft A. Semi-Quantitative Calculations of Primary Tumor Metabolic Activity Using F-18 FDG PET/CT as a Predictor of Survival in 92 Patients With High-Grade Bone or Soft Tissue Sarcoma. Medicine (Baltimore). 2015; 94 (28): e1142.
7. Costelloe C.M., Macapinlac H.A., Madewell J.E., Fitzgerald N.E., Mawlawi O.R., Rohren E.M. et al. 18F-FDG PET/CT as an indicator of progression-free and overall survival in osteosarcoma. J. Nucl. Med. 2009; 50 (3): 340-7.
8. Fuglo H.M., Jorgensen S.M., Loft A., Hovgaard D., Petersen M.M. The diagnostic and prognostic value of 18F-FDG PET/CT in the initial assessment of high-grade bone and soft tissue sarcoma. A retrospective study of 89 patients. Eur. J. Nucl. Med. Mol. Imaging. 2012; 39 (9): 1416-24.
9. Hawkins D.S., Conrad E.U. 3rd, Butrynski J.E., Schuet- ze S.M., Eary J.F. [F-18]-fluorodeoxy-D-glucose-positron emission tomography response is associated with outcome for extremity osteosarcoma in children and young adults. Cancer. 2009; 115 (15): 3519-25.
10. Kim D.H., Kim S.Y., Lee H.J., Song B.S., Kim D.H., Cho J.B. et al. Assessment of Chemotherapy Response Using FDG-PET in Pediatric Bone Tumors: A Single Institution Experience. Cancer Res. Treat. 2011; 43 (3): 170-5.
11. Becher S., Oskouei S. PET Imaging in Sarcoma. Orthop. Clin. North Am. 2015; 46 (3): 409-15.
12. Enneking W.F. A system of staging musculoskeletal neoplasms. Clin. Orthop. Relat. Res. 1986; (204): 9-24.
13. Buchbender C., Heusner T.A., Lauenstein T.C., Boc- kisch A., Antoch G. Oncologic PET/MRI, part 2: bone tumors, soft-tissue tumors, melanoma, and lymphoma. J. Nucl. Med. 2012; 53 (8): 1244-52.
14. Volker T., Denecke T., Steffen I., Misch D., Schonber- ger S., Plotkin M. et al. Positron emission tomography for staging of pediatric sarcoma patients: results of a prospective multicenter trial. J. Clin. Oncol. 2007; 25 (34): 5435-41.
15. Quartuccio N., Treglia G., Salsano M., Matto- li M.V., Muoio B., Piccardo A. et al. The role of Fluorine- 18-Fluorodeoxyglucose positron emission tomography in staging and restaging of patients with osteosarcoma. Radiol. Oncol. 2013; 47 (2): 97-102.
16. Cistaro A., Lopci E., Gastaldo L., Fania P., Brach Del Prever A., Fagioli F. The role of 18F-FDG PET/CT in the metabolic characterization of lung nodules in pediatric patients with bone sarcoma. Pediatr. Blood Cancer. 2012; 59 (7): 1206-10.
17. Iagaru A., Chawla S., Menendez L., Conti P.S. 18F-FDG PET and PET/CT for detection of pulmonary me- tastases from musculoskeletal sarcomas. Nucl. Med. Commun. 2006; 27 (10): 795-802.
18. Quartuccio N., Fox J., Kuk D., Wexler L.H., Balda- ri S., Cistaro A., Schoder H. Pediatric bone sarcoma: diagnostic performance of 18F-FDG PET/CT versus conventional imaging for initial staging and follow-up. AJR Am. J. Roentgenol. 2015; 204 (1): 153-60.
19. Byun B.H., Kong C.B., Lim I., Kim B.I., Choi C.W., Song W.S. et al. Comparison of (18)F-FDG PET/CT and (99 m)Tc-MDP bone scintigraphy for detection of bone metastasis in osteosarcoma. Skeletal Radiol. 2013; 42 (12): 1673-81.
20. Daldrup-Link H.E., Franzius C., Link T.M., Lau-kamp D., Sciuk J., JUrgens H. et al. Whole-body MR imaging for detection of bone metastases in children and young adults: comparison with skeletal scintigraphy and FDG PET. AJR Am. J. Roentgenol. 2001; 177 (1): 229-36.
21. Newman E.N., Jones R.L., Hawkins D.S. An evaluation of [F-18]-fluorodeoxy-D-glucose positron emission tomography, bone scan, and bone marrow aspiration/biopsy as staging investigations in Ewing sarcoma. Pediatr. Blood Cancer. 2013; 60 (7): 1113-7.
22. Klenk C., Gawande R., Uslu L., Khurana A., Qiu D., Quon A. et al. Ionising radiation-free whole-body MRI versus (18)F-fluorodeoxyglucose PET/CT scans for children and young adults with cancer: a prospective, non-ran- domised,
single-centre study. Lancet Oncol. 2014; 15 (3): 275-85.
23. Mentzel H.J., Kentouche K., Sauner D., Fleischmann C., Vogt S., Gottschild D. et al. Comparison of whole-body STIR-MRI and 99mTc-methylene-diphosphonate scintigraphy in children with suspected multifocal bone lesions. Eur. Radiol. 2004; 14 (12): 2297-302.
24. Balaji R. Diagnostic accuracy of whole-body diffusion imaging with background signal suppression(DWIBS) for detection of malignant tumours:a comparison with PET/CT Proc ECR 2012 meeting; poster C-1422. doi: 10.1594/ecr2012/C-1422
25. BickelhauptS., Laun F.B., Tesdorff J., LedererW., Daniel H., Stieber A. et al. Fast and noninvasive characterization of suspicious lesions detected at breast cancer X-ray screening: capability of diffusion-weighted mr imaging with MIPs. Radiology. 2016; 278 (3): 689-97.
26. Stephane V., Samuel B., Vincent D., Joelle G., Remy P., Francois G.G., Jean-Pierre T. Comparison of PET-CT and magnetic resonance diffusion weighted imaging with body suppression (DWIBS) for initial staging of malignant lymphomas. Eur. J. Radiol. 2013; 82 (11): 2011-7.
27. Tomizawa M., Shinozaki F., Uchida Y., Uchiyama K., Fugo K., Sunaoshi T. et al. Diffusion-weighted whole- body imaging with background body signal suppression/ T2 image fusion and positron emission tomography/ computed tomography of upper gastrointestinal cancers. Abdom. Imaging. 2015; 40 (8): 3012-9.
28. Xu L., Tian J., Liu Y., Li C. Accuracy of diffusion-weighted (DW) MRI with background signal suppression (MR- DWIBS) in diagnosis of mediastinal lymph node metastasis of nonsmall-cell lung cancer (NSCLC). J. Magn. Reson. Imaging. 2014; 40 (1): 200-5.
29. Bielack S.S., Smeland S, Whelan J.S., Marina N., Jovic G., Hook J.M. et al. Methotrexate, Doxorubicin, and Cisplatin (MAP) Plus Maintenance Pegylated Interferon Alfa-2b Versus MAP Alone in Patients With Resectable High- Grade Osteosarcoma and Good Histologic Response to Preoperative MAP: First Results of the EURAMOS-1 Good Response Randomized Controlled Trial. J. Clin. Oncol. 2015; 33 (20): 2279-87.
30. Мачак Г.Н., Кочергина Н.В., Сенько О.В., Кузнецова А.В. Клинико-рентгенологические критерии оценки риска на фоне предоперационной химиотерапии остеосаркомы. Вопросы онкологии. 2005; 51 (3): 322-7 [Machak G.N., Kochergina N.V., Sen’ko O.V., Kuznetsova AV. Clinical and roentgenologic criteria for evaluation of risk on the background of osteosarcoma preoperative chemotherapy. Voprosy onkologii. 2005; 51 (3): 322-7 (in Russian)].
31. Fuchs N., Bielack S.S., Epler D., Bieling P., Delling G., Korholz D. et al. Long-term results of the co-operative German-Austrian-Swiss osteosarcoma study group’s protocol COSS-86 of intensive multidrug chemotherapy and surgery for osteosarcoma of the limbs. Ann. Oncol. 1998; 9 (8): 893-9.
32. Hugate R.R., Wilkins R.M., Kelly C.M., Madsen W., Hinshaw I., Camozzi A.B. Intraarterial chemotherapy for extremity osteosarcoma and MFH in adults. Clin. Orthop. Relat. Res. 2008; 466 (6): 1292-301
33. Ku GY, KriplaniA., JanjigianY.Y., Kelsen D.P., RuschV .W., Bains M. et al. Change in chemotherapy during concurrent radiation followed by surgery after a suboptimal positron emission tomography response to induction chemotherapy improves outcomes for locally advanced esophageal adenocarcinoma Cancer. 2016; 122 (13): 2083-90. doi: 10.1002/cncr.30028.
34. Press OW., LiH., Schoder H., Straus D.J., Moskowitz C.H., LeBlanc M. et al. US intergroup trial of response-adapted therapy for stage III to IV Hodgkin Lymphoma using early interim fluorodeoxyglucose-positron emission tomography imaging: southwest oncology group s0816. J. Clin. Oncol. 2016; 34 (17): 2020-7.
35. Rigter L.S., Loo C.E., Linn S.C., Sonke G.S., van Werkhoven E., Lips E.H. et al. Neoadjuvant chemotherapy adaptation and serial MRI response monitoring in ER-positive HER2-negative breast cancer. Br. J. Cancer. 2013; 109 (12): 2965-72.
36. Zinzani P.L., Broccoli A., Gioia D.M., Castagnoli A., Ciccone G., Evangelista A. et al. Interim positron emission tomography response-adapted therapy in advanced- stage Hodgkin lymphoma: final results of the phase II part of the hd0801 study. J. Clin. Oncol. 2016; 34 (12): 1376-85.
37. De Marchi A., Prever E.B., Cavallo F., Pozza S., Linari A., Lombardo P. et al. Perfusion pattern and time of vascu- larisation with CEUS increase accuracy in differentiating between benign and malignant tumours in 216 musculoskeletal soft tissue masses. Eur. J. Radiol. 2015; 84 (1): 142-50.
38. Блудов А.Б. Роль методов лучевой диагностики в оценки эффективности предоперационной химиотерапии у больных с саркомами костей: Дис. ... канд. мед. наук. М.; 2013 [Bludov A.B. Role of radial diagnosis in the evaluation of preoperative chemotherapy efficacy in patients with bone sarcomas. Cand. med. sci. Diss. Moscow; 2013 (in Russian)].
39. Taylor J.S., Reddick W.E. Dynamic contrast-enhanced MR imaging in musculoskeletal tumors. In: Jackson A., Buckley D.L., Parker G.J.M., eds. Dynamic contrast- enhanced magnetic resonance imaging in oncology. Springer Berlin Heidelberg New York; 2005: 215-38.
40. Uhl M., Saueressig U., van Buiren M., Kontny U., Niemey- er C., Kohler G. et al. Osteosarcoma: preliminary results of in vivo assessment of tumor necrosis after chemotherapy with diffusion- and perfusion-weighted magnetic resonance imaging. Invest. Radiol. 2006; 41 (8): 618-23.
41. Benz M.R., Evilevitch V., Allen-Auerbach M.S., Eilber F.C., Phelps M.E., Czernin J., Weber W.A. Treatment monitoring by 18F-FDG PET/CT in patients with sarcomas: interobserver variability of quantitative parameters in treatment-induced changes in histopathologically responding and nonresponding tumors. J. Nucl. Med. 2008; 49 (7): 1038-46.
42. Gupta K., Pawaskar A., Basu S., Rajan M.G., Asopa R.V., Arora B. et al. Potential role of FDG PET imaging in predicting metastatic potential and assessment of therapeutic response to neoadjuvant chemotherapy in Ewing sarcoma family of tumors. Clin. Nucl. Med. 2011; 36 (11): 973-7.
43. Costelloe C.M., Raymond A.K., Fitzgerald N.E., Mawla- wi O.R., Nunez R.F., Madewell J.E. et al. Tumor necrosis in osteosarcoma: inclusion of the point of greatest metabolic activity from F-18 FDG PET/CT in the histopathologic analysis. Skeletal Radiol. 2010; 39 (2): 131-40.
44. Franzius C., Bielack S., Flege S., Sciuk J., Jurgens H., Schober O. Prognostic significance of (18)F-FDG and (99m)Tc-methylene diphosphonate uptake in primary osteosarcoma. J. Nucl. Med. 2002; 43 (8): 1012-7.
45. Hawkins D.S., Schuetze S.M., Butrynski J.E., Rajen- dran J.G., Vernon C.B., Conrad E.U. 3rd, Eary J.F. [18F] Fluorodeoxyglucose positron emission tomography predicts outcome for Ewing sarcoma family of tumors. J. Clin. Oncol. 2005; 23 (34): 8828-34.
46. Bajpai J., Kumar R., Sreenivas V., Sharma M.C., Khan S.A., Rastogi S. et al. Prediction of chemotherapy response by PET-CT in osteosarcoma: correlation with histologic necrosis. J. Pediatr. Hematol. Oncol. 2011; 33 (7): e271-8.
47. Byun B.H., Kong C.B., Lim I., Kim B.I., Choi C.W., Song W.S. et al. Early response monitoring to neoadjuvant chemotherapy in osteosarcoma using sequential 18F-FDG PET/CT and MRI. Eur. J. Nucl. Med. Mol. Imaging. 2014; 41 (8): 1553-62.
48. Byun B.H., Kim S.H., Lim S.M., Lim I., Kong C.B., Song W.S. et al. Prediction of response to neoadjuvant chemotherapy in osteosarcoma using dual-phase (18)F-FDG PET/CT. Eur. Radiol. 2015; 25 (7): 2015-24.
49. Denecke T., Hundsdorfer P., Misch D., Steffen I.G., Schonberger S., Furth C. et al. Assessment of histological response of paediatric bone sarcomas using FDG PET in comparison to morphological volume measurement and standardized MRI parameters. Eur. J. Nucl. Med. Mol. Imaging. 2010; 37 (10): 1842-53.
50. Gaston L.L., Di Bella C., Slavin J., Hicks R.J., Choong P.F. 18F-FDG PET response to neoadjuvant chemotherapy for Ewing sarcoma and osteosarcoma are different. Skeletal Radiol. 2011; 40 (8): 1007-15.
Сведения об авторах:
Мачак Г.Н. — доктор мед. наук, врач-онколог ЦИТО;
Морозов А.К. — доктор мед. наук, зав. отделением лучевой диагностики ЦИТО;
Снетков А.И. — доктор мед. наук, профессор, зав. отделением детской ортопедии ЦИТО;
Карпов И.Н. — канд. мед. наук, старший науч. сотр. отделения лучевой диагностики ЦИТО;
Кочергина Н.В. — доктор мед. наук, профессор, ведущий науч. сотр. НИИ клинической и экспериментальной радиологии РОНЦ им. Н.Н. Блохина;
Блудов А.Б. — канд. мед. наук, науч. сотр. РОНЦ им. Н.Н. Блохина; Рыжков А.В. — канд. мед. наук, РОНЦ им. Н.Н. Блохина.
Теги: саркомы костей
234567 Начало активности (дата): 05.10.2024 10:17:00
234567 Кем создан (ID): 989
234567 Ключевые слова: саркомы костей, мониторинг заболевания, биопсия, метастазы, химиотерапия, метаболизм глюкозы
12354567899
Похожие статьи
Эндопротезирование голеностопного сустава у подростка с последствием гематогенного остеомиелита большеберцовой костиРентген на дому 8 495 22 555 6 8
Перспективные костно-пластические материалы и хирургические технологии при реконструктивно-восстановительном лечении больных с псевдоартрозами и дефектами костной ткани
Клинический случай хордомы крестца и копчика, имеющей массивный внутритазовый компонент (хирургическое лечение с кратким обзором литературы)
Сопроводительная терапия при хирургическом лечении патологических переломов длинных костей и застарелых переломов вертельной области



