 08.05.2025
08.05.2025
Кистозно-адематозная мальформация легкого II типа у новорожденного , проблемы ранней диагностики
Кистозно-аденоматозная мальформация (КАМ) — врожденный порок развития легких, являющийся результатом аномалий морфогенеза ветвления легкого на разных стадиях его, и на разных участках трахеобронхеального дерева, с образованием кист
ВВЕДЕНИЕ
Кистозно-аденоматозная мальформация (КАМ) — врожденный порок развития легких, являющийся результатом аномалий морфогенеза ветвления легкого на разных стадиях его, и на разных участках трахеобронхеального дерева, с образованием кист [1, 2, 3]. Код по Международной классификации болезней 10-го пересмотра — Q33.0.
Данные крупных популяционных исследований показывают, что частота врожденных кист легких составляет один случай на 8 300-35 000 живорождений [4, 5]. На долю КАМ приходится 25% врожденных пороков развития (ВПР) легких, и большинство случаев обнаруживается в период новорожденности или на первом году жизни. Смертность от пренатально диагностированных КАМ широко варьирует и составляет от 9 до 49% [4, 6, 7].
Традиционно КАМ классифицировалась макроскопически по размеру кист и имела три типа (I, II и III) [8]. В настоящее время к классификации добавилось еще два типа (0 и IV), большинство источников объединяет КАМ с другими пороками в группу врожденных пороков развития легких и дыхательных путей [9, 10].
Цель работы — проанализировать особенности течения заболевания и рентгенологические признаки, которые могут помочь врачу заподозрить наличие ВПР легких у новорожденного на ранних стадиях проявления, обосновать дополнительные методы диагностики и своевременно избрать соответствующую тактику лечени
Тип 0 — самая редкая форма (1-3%), развивается из ткани трахеи и крупных бронхов [10]. Порок генерализованно поражает легкое, приводя к тяжелым дыхательным нарушениям. Прогноз неблагоприятный [5].
Тип I — наиболее распространенная форма, составляющая от 60 до 70%. Развивается из бронхиол разного порядка, часто ассоциируется с другими ВПР и характеризуется неблагоприятным прогнозом [11]. Для данного типа присуще наличие крупных единичных кист выстланных реснитчатым столбчатым эпителием. В 95% случаев поражается только одна доля легкого [5]. Вероятность пренатальной диагностики и тяжести клинических проявлений зависит от размера кист.
Тип II встречается в 15-20% случаев. Характеризуется наличием множества мелких кист от 0,5 до 2 см, выстланных кубическим или столбчатым эпителием, перемежающихся с нормальной легочной тканью [6]. Диагностика данного типа КАМ чаще всего происходит после рождения, с неблагоприятным прогнозом на фоне тенденции к росту кист и компрессии окружающих тканей.
Типа III составляют от 5 до 10%. Характеризуется образованием множественных мелких кист до 0,5 см в диаметре из дистальных отделов трахеобронхиального дерева, которые поражают большой объем — от доли до целого легкого. Кисты выстланы кубическим эпителием. Неиммунная водянка и гипоплазия легких часто сопровождает этот тип ВПР легких, с чем и связан частая внутриутробная или ранняя постнатальная гибель ребенка [5, 12]
Тип IV составляет от 5 до 10% КАМ [5, 10]. Размер кист до 7 см. В отличие от предыдущих типов кист, микроскопически выстланных кубическим эпителием, данный тип состоит из уплощенных альвеолярных клеток и часто развивается совместно со злокачественными новообразованиями легких [5].
МАТЕРИАЛ И МЕТОДЫ
В статье представлено клиническое наблюдение за новорожденным ребенком. Использованы медицинские документы, где представлены результаты клинического обследования (физи- кальный осмотр, аускультация и др.), результаты инструментальных (рентген, УЗИ, КТ) и лабораторных методов исследования. Приведены данные гистологического исследования ткани легкого полученного интраоперационно. Информированное согласие законных представителей на обследование и лечение было получено.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Ребенок Н. родился в Екатеринбургском клиническом перинатальном центре в апреле 2021 года в сроке гестации 35 недель с массой тела 2 620 г и длиной тела 49 см.
У матери ребенка Н. в анамнезе три беременности и двое родов (в 2015 году — срочные абдоминальные роды, в 2016 году — медицинский аборт). Настоящая беременность протекала со следующими особенностями: в 10-11 недель анемия легкой степени; гиперблирубинемия; неспецифический вульво-вагинит; эктопия шейки матки, в 25 недель анемия легкой степени. Особенности течения родов: преждевременные абдоминальные роды (кесарево сечение) в 35 недель; рубец на матке; преждевременное излитие околоплодных вод. Иссечение кожного рубца. Безводный период: 11 ч 45 мин., воды светлые. Оценка по шкале Апгар 6/7 баллов.
В родильном зале: отсроченное пережатие пуповины через 1 минуту; помещен на открытое реанимационное место. Учитывая разлитой цианоз, стонущий характер дыхания с нарушениями биомеханики дыхания, начато проведение СРАР (continuous positive airway pressure (англ.) — постоянное положительное давление в дыхательных путях). Учитывая сохраняющуюся потребность в респираторной терапии, транспортирован в ОРИТН в условиях транспортного инкубатора на СРАР.
При поступлении в ОРИТН выставлен диагноз «транзиторное тахипноэ новорожденного»; «другие случаи недоношенности в 35 недель».
В первые сутки, учитывая прогрессирующие дыхательные нарушения, нарастание кислородной зависимости, ребенок переведен на продленную искусственную вентиляцию легких (ИВЛ). Установлен пупочный катетер и начата инфузионная терапия. Учитывая тяжесть состояния, а именно отрицательную динамику по дыхательной недостаточности, потребность в инвазивной
ИВЛ, срок гестации, определена высокая вероятность течения инфекционного процесса. Согласно локальному протоколу «ЕКПЦ», взят бактериологический посев крови и начата эмпирическая антибактериальная терапия.
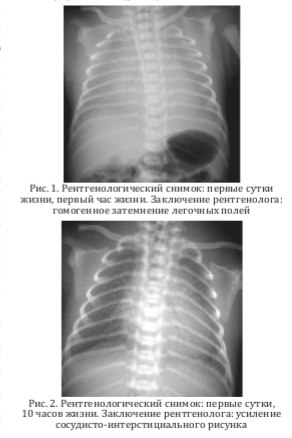
На обзорной рентгенограмме грудной клетки — резкое снижение прозрачности легочных полей, что может соответствовать врожденной пневмонии (рис. 1).
В возрасте одного часа жизни — отрицательная динамика за счет нарастания артериальной гипотензии. Проведена волемическая нагрузка, с целью инотропной поддержки назначен допамин. Учитывая артериальную гипотензию, рефрактерную к волемической нагрузке и инотропной поддержке, состояние расценено как дистрибутивный или септический шок, назначен адреналин с титрованием дозы, дексаметазон. С целью синхронизации ребенка с аппаратом ИВЛ и анальгезии назначен мидазолам и фентанил.
Учитывая клинику шока, антибактериальную терапию, начата антимикотическая терапия. В возрасте шести часов жизни состояние остается крайне тяжелым, стабильное по гемодинамике. По респираторному статусу декомпенсирован. Сатурация лабильная на фоне ИВЛ с FiO2 (фракция кислорода) 1.0, рентгенологическая картина без динамики, сохраняется резкое снижение прозрачности легочных полей, ребенок переведен на ВЧ ИВЛ (высокочастотная ИВЛ). По данным функциональной ЭХО КГ снижены потоки по магистральным сосудам, снижена фракция выброса до 45%. Допамин в терапии заменен на добутамин, продолжено титрование дозы адреналина.
В динамике на рентгенологическом снимке пневматизация легких улучшилась (рис. 2).
На 2 сутки состояние крайне тяжелое за счет дыхательной и сердечно-сосудистой недостаточности, относительно стабильное на фоне проводимой терапии. Учитывая картину левожелудочковой сердечной недостаточности по ЭХО КГ, доза добутамина увеличена до 20 мкг/кг/мин., начато снижение дозировки адреналина. Учитывая оли- гоурию, проведена ограниченная по объему во- лемическая нагрузка. К концу суток состояние с небольшой положительной динамикой за счет уменьшения кислородной зависимости, стабилизации гемодинамики, улучшения сократительной способности миокарда. Темп диуреза достаточный. Лабораторно: WBC 21x109; HGB 172; PLT 264x109; СРБ 0,8 мг/л; по газам крови метаболический ацидоз до pH 7,1 и BE (-14) с положительной динамикой. По данным НСГ: перивентрикулярная ишемия тяжелой степени.Учитывая данные анамнеза, клинику шока в первые сутки жизни, тяжелые дыхательные нарушения, стойкий метаболический ацидоз, данные лабораторно-инструментальных методов обследования, выставлен диагноз: ранний неонатальный сепсис; септический шок; ишемия мозга; другие случаи недоношенности в 35 недель.
На третьи сутки состояние остается тяжелым, переведен на традиционную ИВЛ, продолжается анальгезия фентанилом. Гемодинамика стабилизируется добутамином, адреналином. Трофическое энтеральное кормление не усваивает (рис. 3).
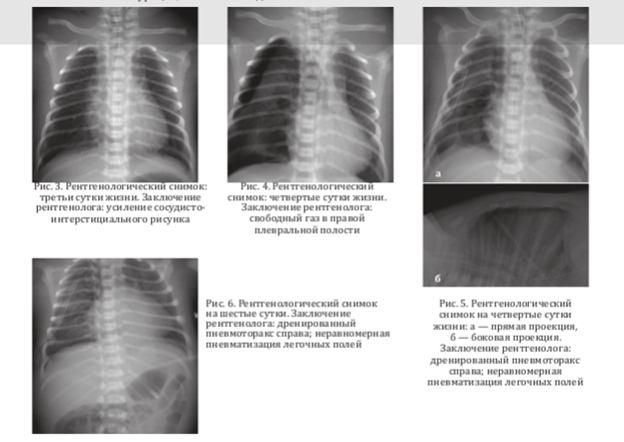
На четвертые сутки продолжается ИВЛ, сохраняется кислородная зависимость. Гемодинамика стабилизируется добутамином, адреналин отменен. Состояние с резко отрицательной динамикой: снижение сатурации, ослабление дыхания справа. На рентгенограмме грудной клетки — правосторонний пневмоторакс с признаками напряжения (рис. 4). Проведено дренирование правой плевральной полости, в четвертом межреберье по среднеаксилярной получен сброс воздуха. Установлен дренаж по Бюлау (рис. 5), состояние ребенка стабилизировалось.
В течение 5-8 суток состояние ребенка — с положительной динамикой. На традиционной ИВЛ, по дренажу сброс воздуха снижается (рис. 6). Се- дация и анальгезия отменены, гемодинамика стабильна цифры артериального давления 68/40 мм рт. ст. без вазоактивных препаратов. Энтеральное кормление усваивает.
На девятые сутки плевральный дренаж перекрыт на фоне отсутствия сброса воздуха. Через 4 часа после перекрытия дренажа на рентгенографии грудной клетки нарастание объема воздуха в плевральной полости, дренаж вновь открыт. Однократно произошел сброс воздуха. Учитывая уровень сознания, минимальные параметры ИВЛ, наличие самостоятельного дыхания, ребенок планово экстубирован. 10 сутки. На рентгенограмме грудной клетки сохраняется небольшое количество воздуха, признаков напряжения нет (рис. 7). Учитывая отсутствие респираторных нарушений, нормальный газовый состав крови, отсутствие напряжения на рентгеновском снимке (парциальный пневмоторакс), и сброса воздуха по дренажу, принято решение удалить дренаж. При контрольном рентгенологическом исследовании в динамике количество воздуха в плевральной полости уменьшалось, признаков напряжения нет.
Дыхание самостоятельное, проводится во все отделы, биомеханика не нарушена. Гемодинамика стабильная. Кормление усваивает по 45 мл через 3 часа, в объеме физиологической потребности.
Стул самостоятельный. Мочится достаточно. Учитывая клиническую картину и лабораторные данные (ОАК и СРБ в норме, ПКТ (прокальцитонин) снизился в динамике с 14 до 0,07 нг/мл) антибактериальная терапия отменена.
Для дальнейшего лечения ребенок переводится в ОПН (отделение патологии новорожденных). Вес при переводе 2361 г, убыль составила 9,8%.
На 13 сутки жизни в условиях ОПН ребенку проведена контрольная рентгенограмма, где обнаружено нарастание количества свободного газа в правой плевральной полости, без смещения средостения.
Несмотря на то, что общее состояние и респираторный статус пациента не страдал, принято решение о его переводе в ОРИТН с целью динамического наблюдения. В условиях отделения реанимации проведена пункция правой
плевральной полости, получен воздух.

На 14 сутки количество воздуха в плевральной полости вновь наросло (рис. 8). Проведена консультация с детским хирургом. Для исключения врожденного порока развития легких и установления причины сохраняющегося СУВ (синдром утечки воздуха) принято решение провести КТ органов грудной клетки в условиях ОДКБ (областной детской клинической больницы). Учитывая нарастание объема воздуха и предстоящую транспортировку,ребенок переведен на ИВЛ, проведена анальгезия фентанилом, и в пятое межреберье по среднеаксилярной линии установлен дренаж по Бюлау, однократно сбросился воздух. На рентгенографии грудной клетки воздуха в плевральной полости нет, легкое расправлено.
Дренаж расположен корректно. По НСГ (нейросонография) в динамике: перивентрикулярная ишемия тяжелой степени; субэпендимальное кровоизлияние 1 степени справа с разряжением.
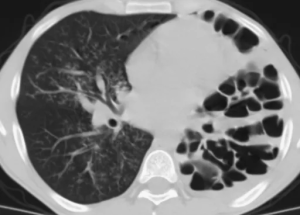
На 15 сутки жизни ребенок Н. в стабильном состоянии на ИВЛ, с открытым дренажом плевральной полости и отсутствием сброса воздуха переведен в ОДКБ. В этот же день проведена КТ органов грудной клетки: на серии КТ органов грудной клетки с толщиной среза 1,5 мм видимые отделы скелета не изменены. В прикорневой зоне C1 и С3 верхней доли справа, парамедиастинально, визуализируются множественные разнокалиберные тонкостенные кисты размером от 5 до 13 мм. Суммарные размеры участка кистозной трансформации 28*14*26 мм. Также отмечается распространение воздуха вдоль сосудов правого корня, по типу интерстициальной эмфиземы. В переднем средостении справа свободный газ толщиной слоя до 15 мм. В правой плевральной полости газ толщиной до З мм. Дренаж в правой плевральной полости, до переднего отрезка 1 ребра. Заключение: Кистозно-аденоматозная мальформация верхней доли правого легкого II типа (рис. 9).

Красными линиями отмечены кисты
За время нахождения пациента в ОРИТН ОДКБ, пневмоторакс сохранялся без тенденции к разрешению. На 22 сутки жизни после предоперационной подготовки, выполнено хирургическое лечение: торакоскопия справа; резекция верхней доли правого легкого (рис. 10).

По заключению гистологического обследования: фрагменты ткани легкого с участками выраженных дис— и ателектазов, очагово-сливными интраальвеолярными кровоизлияниями, отеком межуточной стромы с множеством полостей, выстланным мерцательным цилиндрическим эпителием, между которыми определяются соединительнотканные прослойки и растянутые альвеолы; морфологическая картина не противоречит клиническому диагнозу и более соответствует КАМ II типа.
После непродолжительного послеоперационного периода и наркотической анальгезией, ребенок переведен не обезболивание нестероидными пртивовоспалительными средствами, что позволило провести экстубацию на третьи сутки после операции. В этот же день после пробы с пережатием удален дренаж плевральной полости. На 26 сутки жизни ребенок переведен в отделение хирургии новорожденных. В течение нескольких дней сохранялась небольшая кислородная зависимость, без нарушений биомеханики дыхания. Ребенок выписан домой в удовлетворительном состоянии на 35 суки жизни. Диагноз при выписке: Основное заболевание — врожденный порок развития: кистозно-аденоматозная мальформация верхней доли правого легкого. Осложнение — пневмоторакс справа (дренированный), пневмомедиастинум.
Сопутствующие диагнозы: Реконвалесцент раннего неонатального сепсиса. Церебральная ишемия. Синдром двигательных нарушений по миатоническому типу. Фон: Недоношенность 35 недель.
ОБСУЖДЕНИЕ
Целью представления данного клинического случая является совместный поиск возможности более ранней диагностики, что позволит правильно установить диагноз, снизить количество медицинских вмешательств и провести своевременное оперативное лечение. На примере данного клинического случая ниже проведен анализ возникших проблем на каждом этапе жизни пациента.
Пренатальная диагностика является первым этапом возможного обнаружения ВПР легких и своевременного направления беременной на роды в перинатальный центр с наличием детской хирургической службы. Выявление КАМ по УЗИ имеет низкую специфичность и зависит от размера кист, может быть проведено, начиная со второго триместра [13, 14, 15]. В нескольких исследованиях предложена возможность применения методики, используемой для обнаружения врожденной диафрагмальной грыжи для выявления КАМ, а именно: расчет отношения площади легких к окружности головки плода [16, 17]. Так же в литературе имеется описание эффективного пренатального применения магнитно-резонансной томографии с целью верификации уже выявленного или подозреваемого по УЗИ порока. Несмотря на то, что в представленном случае женщина прошла все три УЗИ скрининга, ВПР у плода выявлен не был. Как уже описано выше, КАМ II типа чаще всего выявляется постнатально, на фоне роста кист.
По данным литературы, клиническая картина КАМ характеризуется следующими проявлениями: дыхательные нарушения различной степени выраженности, спонтанный рецидивирующий пневмоторакс и присоединение инфекции дыхательных путей [18]. В зависимости от объема поражения, клинические проявления могут отсутствовать у 75% пациентов с пренатально диагностированной КАМ [12, 19, 20].
В представленном случае ребенок имел врожденный генерализованный инфекционный процесс, в том числе с поражением легких, клинической и рентгенологической картиной врожденной пневмонии. Развившийся на четвертые сутки пневмоторакс клиницистами был связан именно с повреждением легкого пневмонией. Тяжесть инфекции, жесткие параметры ИВЛ в первые трое суток жизни казались логичным объяснением причины рецидивирующего СУВ. Именно на этапе рецидива пневмоторакса, уместным выглядит более точечный сбор семейного анамнеза в разговоре с родителями ребенка. Выявление врожденных пороков развития, рака легких, эпизоды спонтанного пневмоторакса у родственников, можно также связать с КАМ [21]. Генетические предпосылки данного заболевания в настоящий момент не ясны, но продолжают изучаться [5].
К инструментальным методам диагностики в постнатальном периоде, относится в первую очередь рентген органов грудной клетки. На снимках можно однозначно определить только крупные кисты заполненные воздухом, или имеющие уровень жидкости. При втором типе КАМ можно увидеть более однородные мелкие кисты. Несмотря на достоверность рентгенологического метода при различных легочных патологиях, исследование F. Sauvat [22] показало нормальную рентген картину легких у 12 из 29 пациентов (41%) с пренатально диагностированной КАМ, и на КТ у 11 из 12 этих пациентов ВПР был подтвержден. В представленном случае, рентген картина характеризовалась, как врожденная пневмония в 1-3 сутки и не имела признаков очаговых изменений, что затруднило диагностику КАМ сразу после рождения. В дальнейшем все участки повышенной пневмотизации были связаны именно с СУВ и скоплением воздуха в прикорневой зоне. Ребенку регулярно проводились рентгенологические снимки в прямых и боковых проекциях, с целью исключения стояния дренажа в ткани легкого. Во всех случаях дренаж занимал корректное положение и функционировал без признаков повреждения легкого.
УЗИ легких проводилось пациенту Н. двумя врачами, как в первые дни, так и после развития СУВ, подозрений на порок развития легкий не выявлено. УЗИ хоть и является перспективным методом диагностики патологии легких, но в настоящий момент полноценно он не вошел в рутинную практику неонатальных отделений, а в литературе не обнаружено достаточно данных, позволяющих корректно провести выявление КАМ по УЗИ [23].
КТ и МРТ являются общепринятым «золотым» стандартом диагностики как пренатально установленного ВПР легких, так и прижизненно диагностированного или подозреваемого порока [24, 25]. Как показано в представленном клиническом случае, только КТ диагностика позволила точно установить диагноз и определить дальнейшую тактику лечения.
Консервативное лечение КАМ достаточно спорно, и описано в литературе только у пациентов с бессимптомным течением заболевания. Его положительной стороной является попытка избежать хирургической агрессии и возможных осложнений, связанных с анестезией, операцией и послеоперационным периодом. К недостаткам консервативного подхода относятся частые нагноения кист и рецидивирующие пневмонии у пациентов [26, 27]. Хирургическая лечение решает проблему с инфекцией и рассматривается также как профилактика возможной малигнизации кист [28]. У пациентов с бессимптомным течением срок планового оперативного вмешательство точно не определен и по разным источникам рекомендован от 1 до 12 месяцев жизни [29].
В случае пациента Н., клинические проявления в виде рецидивирующего пневмоторакса привели к выбору оперативной тактики лечения, что полностью соотносится с международными данными [30]. Однако, несмотря на то, что диагноз КАМ по КТ установлен на 15 сутки жизни, и имелись значительные дыхательные нарушения, операция проведена только через 7 дней (22 сутки жизни).
Как итог несвоевременной диагностики КАМ на этапе пре— и постнатального обследования, роды произошли в непрофильном стационаре, ребенок проходил лечение в двух клиниках и трех отделениях, и госпитализация заняла 35 дней, что, безусловно, сказывается на физическом и психологическом состоянии ребенка и матери.
ЗАКЛЮЧЕНИЕ
Диагностика КАМ на ранних этапах была затруднена не только в связи с характером порока, но и клиникой сепсиса, которая являлась ведущей в первые дни жизни. Повреждение легких и персистирующий пневмоторакс, по мнению лечащих врачей, на начальных этапах лечения были следствием течения тяжелой врожденной пневмонии, как локального проявления генерализованного инфекционного процесса. Морфология порока развития ведет к проблемам с его пренатальной диагностикой и отсутствием ясной рентгенологической и УЗИ картины в постнатальном периоде. В любом случае рецидивирующего СУВ имеет смысл проводить дифференциальную диагностику с ВПР легких и для точной визуализации использовать КТ или МРТ.
СПИСОК ИСТОЧНИКОВ
Wilson RD, Hedrick HL, Liechty KW, Flake AW, Johnson MP, Bebbington M, Adzick NS. Cystic adenomatoid malformation of the lung: review of genetics, prenatal diagnosis, and in utero treatment. Am J Med Genet A. 2006;140(2):151-5.
Baird R, Puligandla PS, Laberge JM. Congenital lung malformations: informing best practice. Semin Pediatr Surg. 2014 Oct; 23(5):270-7. doi: 10.1053/j.sempedsurg.2014.09.007. Epub 2014 Sep 4. PMID: 25459011.
Shanti CM, Klein MD. Cystic lung disease. Semin Pediatr Surg. 2008 Feb;17(1):2-8. doi: 10.1053/j.sempedsurg.2007.10.002. PMID: 18158136.
Laberge JM, Flageole H, Pugash D, Khalife S, Blair G, Filiatrault D, Russo P, Lees G, Wilson RD. Outcome of the prenatally diagnosed congenital cystic adenomatoid lung malformation: a Canadian experience. Fetal Diagn Ther. 2001 May- Jun;16(3):178-86. doi: 10.1159/000053905. PMID: 11316935.
Priest Jr, Williams GM, Hill DA, Dehner LP, Jaffe A. Pulmonary cysts in early childhood and the risk of malignancy. Pediatr Pulmonol. 2009 Jan;44(1):14-30. doi: 10.1002/ppul.20917. PMID: 19061226.
Usui N, Kamata S, Sawai T, Kamiyama M, Okuyama H, Kubota A, Okada A. Outcome predictors for infants with cystic lung disease. J Pediatr Surg. 2004 Apr;39(4):603-6. doi: 10.1016/j.jpedsurg.2003.12.001. PMID: 15065037.
Adzick NS, Harrison MR, Crombleholme TM, Flake AW, Howell LJ. Fetal lung lesions: management and outcome. Am J Obstet Gynecol. 1998 Oct;179(4):884-9. doi: 10.1016/s0002-9378(98)70183-8. PMID: 9790364.
Stocker JT, Madewell JE, Drake RM. Congenital cystic adenomatoid malformation of the lung. Classification and morphologic spectrum. Hum Pathol. 1977 Mar;8(2):155-71. doi: 10.1016/s0046-8177(77)80078-6. PMID: 856714.
Stocker JT. Congenital pulmonary airway malformation—anewname for and an expanded classification of congenital cysticadenomatoid malformation of the lung. Histopathology 2002;41:424-431.
van Koningsbruggen S, Ahrens F, Brockmann M, Michalk D, Rietschel E. Congenital cystic adenomatoid malformation type 4. Pediatr Pulmonol. 2001 Dec;32(6):471-5. doi: 10.1002/ppul.1160. PMID: 11747251.
Под ред. Ю.Ф. Исакова. Неонатальная хирургия. 1-е изд. М: « Династия» 2011, 311-332
Ruchonnet-Metrailler I, Leroy-Terquem E, Stirnemann J, Cros P, Ducoin H, Hadchouel A, Khen-Dunlop N, Labbe A, Labouret G, Lebras MN, Lezmi G, Madhi F, Salomon Lj, Thouvenin G, Thumerelle C, Delacourt C. Neonatal outcomes of prenatally diagnosed congenital pulmonary malformations. Pediatrics. 2014 May;133(5):e1285-91. doi: 10.1542/peds.2013-2986. PMID: 24777224.
Adzick NS, Harrison MR, Crombleholme TM, Flake AW, Howell LJ. Fetal lung lesions: management and outcome. Am J Obstet Gynecol. 1998 Oct;179(4):884-9. doi: 10.1016/s0002-9378(98)70183-8. PMID: 9790364.
Adzick NS, Harrison MR, Glick PL, Golbus MS, Anderson RL, Mahony BS, Callen PW, Hirsch JH, Luthy DA, Filly RA, et al. Fetal cystic adenomatoid malformation: prenatal diagnosis and natural history. J Pediatr Surg. 1985 Oct;20(5):483-8. doi: 10.1016/s0022-3468(85)80470-x. PMID: 3903097.
Taguchi T, Suita S, Yamanouchi T, Nagano M, Satoh S, Koyanagi T, Nakano H. Antenatal diagnosis and surgical management of congenital cystic adenomatoid malformation of the lung. Fetal Diagn Ther. 1995 Nov-Dec;10(6):400-7. doi: 10.1159/000264265. PMID: 8579779.
Baird R, Puligandla PS, Laberge JM. Congenital lung malformations: informing best practice. Semin Pediatr Surg. 2014 Oct;23(5):270-7. doi: 10.1053/j.sempedsurg.2014.09.007. Epub 2014 Sep 4. PMID: 25459011.
Crobleholme TM, Coleman B, Hedrick H, Liechty K, Howell L, Flake AW, Johnson M, Adzick NS. Cystic adenomatoid malformation volume ratio predicts outcome in prenatally diagnosed cystic adenomatoid malformation of the lung. J Pediatr Surg. 2002 Mar;37(3):331-8. doi: 10.1053/jpsu.2002.30832. PMID: 11877643.
Parikh DH, Rasiah SV. Congenital lung lesions: Postnatal management and outcome. Semin Pediatr Surg. 2015 Aug;24(4):160-7. doi: 10.1053/j.sempedsurg.2015.01.013. Epub 2015 Feb 3. PMID: 26051048.
Sauvat F, Michel JL, Benachi A, Emond S, Revillon Y. Management of asymptomatic neonatal cystic adenomatoid malformations. J Pediatr Surg. 2003 Apr;38(4):548-52. doi: 10.1053/jpsu.2003.50119. PMID: 12677563.
Aziz D, Langer JC, Tuuha SE, Ryan G, Ein SH, Kim PC. Perinatally diagnosed asymptomatic congenital cystic adenomatoid malformation: to resect or not? J Pediatr Surg. 2004 Mar;39(3):329-34; discussion 329-34. doi: 10.1016/j. jpedsurg.2003.11.021. PMID: 15017547.
Priest JR, Watterson J, Strong L, Huff V, Woods WG, Byrd RL, Friend SH, Newsham I, Amylon MD, Pappo A, Mahoney DH, Langston C, Heyn R, Kohut G, Freyer DR, Bostrom B, Richardson MS, Barredo J, Dehner LP. Pleuropulmonary blastoma: a marker for familial disease. J Pediatr 1996;128:220-224
Sauvat F, Michel JL, Benachi A, Emond S, Revillon Y. Management of asymptomatic neonatal cystic adenomatoid malformations. J Pediatr Surg. 2003 Apr;38(4):548-52. doi: 10.1053/jpsu.2003.50119. PMID: 12677563.
Quercia M, Panza R, Calderoni G, Di Mauro A, Laforgia N. Lung Ultrasound: A New Tool in the Management of Congenital Lung Malformation. Am J Perinatol. 2019 Jul;36(S 02):S99-S105. doi: 10.1055/s-0039-1692131. Epub 2019 Jun 25. PMID: 31238368.
Kim WS, Lee KS, Kim IO, Suh YL, Im JG, Yeon KM, Chi JG, Han BK, Han MC. Congenital cystic adenomatoid malformation of the lung: CT-pathologic correlation. AJR Am J Roentgenol. 1997 Jan;168(1):47-53. doi: 10.2214/ajr.168.1.8976918. PMID: 8976918.
Kim WS, Lee KS, Kim IO, Suh YL, Im JG, Yeon KM, Chi JG, Han BK, Han MC. Congenital cystic adenomatoid malformation of the lung: CT-pathologic correlation. AJR Am J Roentgenol. 1997 Jan;168(1):47-53. doi: 10.2214/ajr.168.1.8976918. PMID: 8976918.
Singh R, Davenport M. The argument for operative approach to asymptomatic lung lesions. Semin Pediatr Surg. 2015 Aug;24(4):187-95. doi: 10.1053/j.sempedsurg.2015.02.003. Epub 2015 Feb 27. PMID: 26051052.
Stanton M. The argument for a non-operative approach to asymptomatic lung lesions. Semin Pediatr Surg. 2015 Aug;24(4):183-6. doi: 10.1053/j.sempedsurg.2015.01.014. Epub 2015 Feb 3. PMID: 26051051.
Baird R, Puligandla PS, Laberge JM. Congenital lung malformations: informing best practice. Semin Pediatr Surg. 2014 Oct;23(5):270-7. doi: 10.1053/j.sempedsurg.2014.09.007. Epub 2014 Sep 4. PMID: 25459011.
Jelin Eb, O'Hare EM, Jancelewicz T, Nasr I, Boss E, Rhee DS. Optimal timing for elective resection of asymptomatic congenital pulmonary airway malformations. J Pediatr Surg. 2018 May;53(5):1001-1005. doi: 10.1016/j.jpedsurg.2018.02.032. Epub 2018 Feb 10. PMID: 29514740.
Muller CO, Berrebi D, Kheniche A, Bonnard A. Is radical lobectomy required in congenital cystic adenomatoid malformation? J Pediatr Surg. 2012 Apr;47(4):642-5. doi: 10.1016/j.jpedsurg.2011.08.002. PMID: 22498375.
Сведения об авторе:
Е.В. Шестак — врач анестезиолог-реаниматолог
Автор выражает благодарность
Губиной Александре Михайловне за подготовку информационной базы, докторам ЕКПЦ
Светлаковой Дарье Викторовне, Федотовой Ольге Игоревне, Баранец Елене Владимировне, докторам ОДКБ
Швалеву Федору Михайловичу, Кабдрахмановой Ольге Танюхановне, Гек Екатерине Васильевне — за сбор данных и фотографий
Теги: кистозно-аденоматозная мальформация легкого
234567 Начало активности (дата): 08.05.2025
234567 Кем создан (ID): 989
234567 Ключевые слова: кистозно-аденоматозная мальформация легкого, врожденный порок развития легкого, пневмоторакс, новорожденный, рентген, КТ
12354567899
Похожие статьи
Особенности ортопедической патологии у больных нейрофиброматозом I типаРентген на дому 8 495 22 555 6 8
Эндопротезирование головки таранной кости при лечении болезни Мюллера - Вейса: три клинических случая
Нейрохирурги института Склифосовского извлекли из затылка пациента образование размером с мяч



