 24.05.2025
24.05.2025
Теоретические основы анализа КТ-изображений образований органов брюшной полости : обзор
Радиомика, или текстурный анализ представляет собой метод обработки медицинских изображений, позволяющий осуществлять комплексную оценку структуры новообразования путем извлечения большого числа количественных признаков, отражающих распределение значений пикселей или вокселей
Введение.
Лучевые методы исследования, такие как мультиспиральная КТ с внутривенным контрастированием, МРТ с внутривенным контрастированием и последующая морфологическая верификация выявленных образований играют решающую роль в диагностике.
Использование новых методик анализа диагностических изображений, таких как искусственный интеллект и радиомика, позволяет более глубоко изучить структуру новообразований по полученным данным неинвазивных методик КТ, МРТ, УЗИ [1].
Радиомика — направление медицинской визуализации, применяемое для извлечения количественных характеристик (радиомических признаков) из медицинских изображений для последующего анализа и использования их в диагностике, прогнозе и лечении заболеваний.
Радиомические признаки отражают распределение значений пикселей или вокселей на изображении [2]. В некоторых изученных исследованиях уравнены понятия радиомики и текстурного анализа, так как анализ текстуры — один из ключевых этапов радиомики. Однако, помиимо текстурных показателей, также используются объемные, геометрические и другие характеристики.
В то время как с помощью биопсии возможно исследовать лишь небольшую часть опухоли и обычно только в одном анатомическом участке, с помощью радиомики возможно оценить всю опухоль, а также перитуморальную область и нормальную паренхиму [3]. Анализируя выявленные радиомические показатели, можно создавать алгоритмы (радиомические модели) для диагностики различных патологических состояний, определения гистологического подтипа образования, его молекулярного и генетического профиля, оценки микрососудистой инвазии, прогнозирования эффективности лечения, риска метастазирования и рецидива. Радиомические модели бывают двух основных типов: диагностические и прогностические модели.
Процесс создания радиомической модели включает в себя следующие этапы [4]:
1) получение изображений;
2) обработка изображений:
— нормализация/гармонизация изображений (интерполяция, дискретизация и др.);
— сегментация;
— ресегментация;
— применение фильтров;
3) вычисление радиомических показателей из зоны интереса с помощью специализированного программного обеспечения;
4) предварительная обработка радиомических показателей, статистический анализ для отбора релевантных радиомических показателей;
5) разработка радиомической (диагностиче- ской/прогностической) модели.
Цель. Провести анализ данных литературы, посвященной технологии, возможностям и перспективам радиомики КТ-изображений образований органов брюшной полости.
Материалы и методы.
Проведено изучение зарубежной литературы, посвященной применению текстурного анализа в базе данных PubMed, а также сравнение данных литературы с результатами изучения радиомики специалистами НМИЦ хирургии им. А. В. Вишневского. Публикации отбирали по ключевым словам «radiomics», «CT», «texture analysis», «liver», «abdomen», «GIST», «pancreas», «metastases». Поиск ограничивали только работами 2018 - 2024 гг., преимущественно посвященными радиомике образований органов брюшной полости.
Надежность радиомических моделей в радиомике.
Для применения радиомики в клинической практике модели должны быть надежны и стабильны. Для этого при обучении моделей необходимо использовать повторяемые и воспроизводимые радиомические показатели/признаки (РП).
Повторяемые РП — неизменны при повторном сканировании объекта без изменения условий сканирования.
Воспроизводимые РП — неизменны при получении изображений на другом оборудовании, с использованием другого программного обеспечения, другого протокола сканирования [5].
Существует несколько способов повысить повторяемость и воспроизводимость.
1. Стандартизация — разработка единых алгоритмов для всех этапов текстурного анализа, единой номенклатуры радиомических показателей и фильтров, платформ для текстурного анализа. IBSI (Image Biomarker Standardisation Initiative) — это независимое международное сотрудничество, которое занимается стандартизацией радиомики [4].
2. Обработка изображений (применение фильтров, нормализация, интерполяция, автоматическая/полуавтоматическая или качественная ручная сегментация изображений, ресегментация, дискретизация).
3. Подробное описание методологии исследований позволяет другим исследователям повторить его и проверить полученные результаты.
4. Создание больших баз данных с медицинскими изображениями. Надежность результатов радиомики зависит от количества и качества используемых данных. Для развития радиомики необходимо большое количество стандартизированных изображений из разных центров с морфологической верификацией диагноза. Существуют большие общедоступные базы данных, например, The Cancer Imaging Archive (TCIA) [6]. Таким образом, можно увеличить разнообразие данных и сократить время получения используемых для исследований изображений [7].
Получение изображений.
В изученных исследованиях по текстурному анализу образований органов брюшной полости пациентам преимущественно выполняли КТ-исследования органов брюшной полости с контрастированием [2, 8, 9].
Несмотря на то, что в некоторых исследованиях возможно проведение анализа изображений, полученных с разными протоколами сканирования, важно отметить, что обычно для воспроизводимости результатов необходимо использовать единые (стандартизированные) протоколы исследований, то есть стандартизировать дозы, алгоритмы реконструкции, толщину срезов, временной промежуток между введением контрастного препарата и сканированием [10].
Нормализация/гармонизация. Нормализация/ гармонизация изображений необходима для снижения вариабельности между ними, так как медицинские изображения, даже одного и того же пациента, могут значительно отличаться в зависимости от используемого оборудования, параметров сканирования и условий съемки. Предварительная обработка помогает уменьшить эту вариабельность, делая изображения более сопоставимыми [11, 12].
Существует множество различных методов нормализации/гармонизации изображений, например, дискретизация интенсивностей и интерполяция (подробно описаны в разделе «Обработка изображений»), стандартизация (z-score), распределение интенсивности, применения нейронных сетей [13], нормализация ядер реконструкции [14]; повышение контрастности [15, 16].
Нормализация/гармонизация радиомических показателей. Нормализация и гармонизация применима для обработки не только изображений, но и РП (используется на этапе обработки РП). Чтобы исправить изменчивость, вызванную алгоритмом реконструкции и толщиной среза, типом сканера, возможно применение нейронных сетей [17], ComBat [18] и др.
M. Ligero и соавт. (2020) исследовали методы предварительной обработки на основе SVD (при котором основные компоненты, связанные с изменчивостью, отфильтровываются из данных, и матрица восстанавливается без этих данных) и ComBat (Combining Batches — основан на эмпирическом методе Байеса). Они применяются не к изображениям, а непосредственно к числовым значениям радиомических признаков. В ходе исследования оба метода улучшили воспроизводимость РП. При использовании ComBat диагностическая модель была более эффективна [18]. Преимуществом этого метода является возможность применения с небольшими наборами данных [12].
T. Refaee и соавт. (2022) исследовали методы RKN и ComBat для улучшения воспроизводимости радиомических характеристик при сканировании, полученном с разными ядрами реконструкции на разных моделях сканеров.
Нормализация ядер реконструкции (Reconstruction Kernels Normalization (RKN) — процесс преобразования данных так, чтобы они имели характеристики, аналогичные выбранной эталонной реконструкции). Применяется чтобы уменьшить вариативность данных, полученных с помощью разных ядер реконструкции [14]. Большинство радиомических характеристик были чувствительными к изменению ядер реконструкции. После применения RKN и ComBat воспроизводимость увеличилась в 28,4% и 53,7% случаев соответственно. При совместном использовании обоих методов воспроизводимость увеличилась в 79,1% случаев [14].
Хотя гармонизации/нормализация имеет большой потенциал, для ее успешной реализации крайне важно гарантировать, что данный этап предварительной обработки не приведет к потере информации или снижению информативности обработанных данных. Процесс гармонизации/нормализации также требует стандартизации.
Обработка изображений.
Фильтры — математические преобразования, которые используются для выделения определенных характеристик изображений и получения текстурных показателей высшего порядка [4]. Фильтры применяются на этапе получения РП (встроены в программы для извлечения при¬знаков). После применения фильтра получают новое изображение (response map), из которого извлекают текстурные показатели высшего порядка.
1. All-pass фильтры редко используются в радиомике, не влияют на частотный компонент изображения.
Примеры:
— Identity фильтр;
— Translation фильтр.
2. Low-pass фильтры (низкочастотные фильтры) ослабляют высокочастотный компонент изображения, создавая более размытую (сглаженную) версию изображения, снижают шум.
Примеры:
— Mean filter;
— Gaussian
filter.
3. High-pass фильтры (высокочастотные фильт¬ры) ослабляют низкочастотный компонент изображения, увеличивая детализацию изображений, могут усиливать шум. Примеры:
— Sobel and Laplacian filters;
— Fourier transform.
4. Band-pass фильтры ослабляют как высокочастотный, так и низкочастотный компоненты изображения, оставляя только определенный спектр частот. Могут использоваться для выделения определенных структурных паттернов, таких как фиброз или некроз.
Примеры:
— The Laplacian of Gaussian (LoG);
— Gabor filter;
— Wavelets;
Сегментация.
Сегментация изображений — выделение интересующей исследователей области на изображениях [2]. Это очень важный этап, выделенная область влияет на радиомические показатели, их воспроизводимость. В большей части изученных публикаций сегментировали только опухоль, в других, дополнительно, перитуморальные ткани (например, для оценки микрососудистой инвазии — предиктора высокой частоты рецидивов у пациентов с ГЦК после резекции или трансплантации) [19, 20].
Виды сегментации:
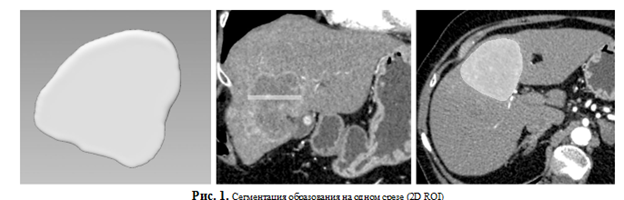
— двухмерная (2D) область интереса (2D region of interest или 2D ROI) — образование сегментируют на одном наиболее информативном срезе сканирования (рис. 1);
— Laws kernels.
Наиболее часто применяют the Laplacian of Gaussian (LoG) и Wavelet фильтры. The Laplacian of Gaussian (LoG) состоит из двух фильтров. Gaussian применяет гауссово размытие, сглаживая изображение и уменьшая высокочастотные компоненты. Сглаживание изображения происходит за счет выбора определенного параметра «сигмы» (s): чем больше значение s, тем больше размытие и больше сглаживается шум. The Laplacian используется после применения Gaussian фильтра и выделяет области быстрого изменения интенсивности [1, 4].
Wavelets — большая группа фильтров, содержащие различные комбинации высоко- и низкочастотных фильтров [4].
При использовании фильтрации стоит помнить, что некоторые данные могут быть потеряны [11]. И поэтому использование для текстурного анализа только лишь карт отклика не рекомендовано.
Фильтры также требуют стандартизации. IBSI 2 — проект по стандартизации фильтров уже завершен. Из 486 признаков, полученных после применения фильтров, 458 оказались воспроизводимыми. Восемь типов фильтров были стандартизированы. Для более детального изучения фильтров стоит обратиться к руководству IBSI 2 «Standardised con-volutional filtering for Radiomics» [4].
— трехмерная (3D) область интереса (3D ROl/volume of interest или VOI) — образование сегментируют на всех срезах (рис. 2);
— модифицированные методы — включают в себя сегментацию с обрезанием (рис. 3) или расширением ROI (рис. 4).
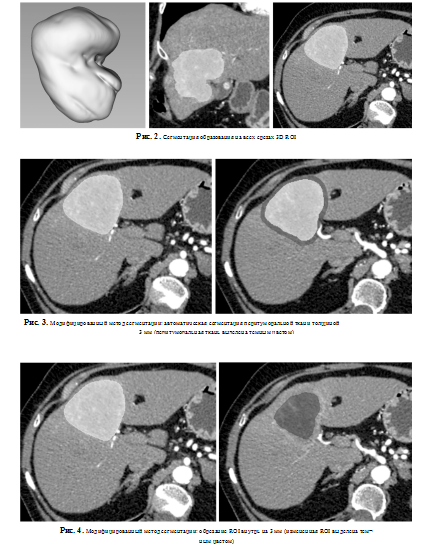
Для сегментации доступны различные программы, выбор следует основывать на удобстве использования каждым конкретным исследователем: MaZda, LifeX, ePAD, IBEX, 3D Slicer, MITK, ITK- SNAP, MeVisLab, ImageJ [7, 21].
Выделять образования возможно вручную или с использованием полуавтоматических и автоматических методов. Например, в некоторых изученных исследованиях образования сегментировали с использованием предварительно обученной нейросети nnU- net [22-24]. Автоматическая сегментация изображений, безусловно, является лучшим вариантом, поскольку она позволяет избежать влияния человеческого фактора на сегментацию.
Однако пока ее применение ограничено. Необходима разработка воспроизводимых алгоритмов автоматической сегментации образований [21].
В большинстве имеющихся на данный момент исследований
выполняли ручную 3D-сегментацию изображений. Использование 3D ROI более
предпочтительно, так как данный инструмент меньше зависит от различий сегментации и доказана высокая воспроизводимость полученных результатов [2].
После выделения образования возможно обрезание по краям (erosion function) [24] или расширение ROI [20, 25].
Например, H. Chu и соавт. (2021) для прогнозирования рецидива опухоли разработали несколько радиомических моделей. Для прогнозирования ран-него рецидива комбинированная радиомически-клиническая модель с выделением опухоли и 5 мм перитуморальной области показала наивысшую эффективность (AUC 0,805) [1, 26].
Сегментация изображений может быть проведена на одной из фаз исследования и на нескольких фазах исследования [22, 27-29].
Обычно выбирают фазы с наилучшей визуализацией образования. При сравнении результатов текстурного анализа с использованием одной или нескольких фаз определили, что лучше использовать несколько фаз [30].
Для выделения образований на нескольких фазах можно использовать регистрацию изображений (существуют такие виды регистрации изображений, как rigid, affine и deformable). Для простого копирования используют rigid регистрацию: выделяют 3D ROI в одну из фаз исследования, затем выполняется копирование сегментации на другую фазу (можно отредактировать вручную) [2, 31].
При сегментации во многих исследованиях не выделяли или исключали из области интереса внутриочаговые участки некроза, кистозные изменения, кальцинаты, кровеносные сосуды, печеночные протоки [32, 33].
Интерполяция (настройка изотропного размера вокселя) [4, 9, 18, 23]. Размер вокселя имеет наибольшее влияние на радиомические показатели, особенно зависимы показатели текстуры [18]. Перед проведением анализа изображений необходимо приведение изображений к изотропному вокселю, так как интерполяция повышает воспроизводимость, согласованность результатов, количество необходимых РП, позволяет сравнивать данные между разными исследованиями [4, 9].
Существуют различные алгоритмы интерполяции (nearest neighbour interpolation, trilinear interpola¬tion, linear interpolation, cubic convolution interpolation, cubic spline interpolation, tricubic spline interpoation). Хотя не существует единого мнения относительно выбора алгоритма интерполяции, обычно используют trilinear interpolation [4].
Выбор алгоритма также влияет на воспроизводимость радиомических показателей. Например, T. Kuben и соавт. выявили, что cubic spline interpolation или linear interpolation предпочтительнее nearest neighbour interpolation [34].
Ресегментация (настройка диапазона уровней серого) [4, 9]. Может выполняться для удаления вокселей из ранее сегментированной ROI, которые выходят за пределы заданного диапазона уровней серого [4]. Например, применение ограничения от 0 до 300 HU позволяет исключить из выделенной области интереса газ, жировую ткань и кальцинаты, что предотвращает влияние прилежащих полых органов и жировой клетчатки на полученные текстурные признаки [4, 8, 23]. Выбор диапазона ресегментации зависит от характеристик образования и целей исследования.
Дискретизация интенсивности изображения внутри ROI/VOI (fixed bin size, fixed bin width, fixed bin number, histogram equalisation, Lloyd-Max, minimum mean squared) [4, 21].
Дискретизация, или квантование интенсивностей изображения внутри ROI — разбиение диапазона значений непрерывной или дискретной величины на конечное число интервалов, то есть диапазон уровней серого сокращается до заранее определенного числа [3]. Часто требуется для упрощения расчета радиомических показателей, а также обладает свойствами шумоподавления, повышает воспроизводимость. Обычно используют два типа дискретизации (дискретизацию до фиксированного количества ячеек (fixed bin number/FBN) и дискретизация до фиксированного размера ячеек (fixed bin size/ FBS согласно IBSI) [4].
Для КТ-исследований можно использовать оба метода. Однако если ресегментация не проводилась, то применение алгоритма FBS не рекомендуется, так как при дискретизации с фиксированным размером ячейки используется нижняя граница диапазона ресегментации в качестве минимального установленного значения [4, 21].
Стоит отметить, что PyRadiomics использует дискретизацию до фиксированной ширины ячеек (fixed bin width/FBW) вместо FBS. При применении FBW минимальное установленное значение не зависит от диапазона ресегментации, а используется самое низкое значение уровня серого [35].
Преднастройка на фантомах. Фантомы в радио- мике используются для оценки воспроизводимости радиомических признаков, тестирования новых технологий и методов, а также для стандартизации и контроля качества данных.
Преднастройка на фантоме позволяет настроить и проверить работу сканера перед началом исследования. Это позволяет избежать многократного воздействия радиации на пациента и утомительных протоколов сканирования.
Фантом сканируют, используя те же параметры, что и при сканировании пациентов и оценивают качество изображений и правильно ли настроен сканер.
Радиомические фантомы — фантомы с предварительно выделенными «эталонными» РП. Их исполь-зуют для оценки этапа обработки изображений или программ для выделения радиомических признаков.
IBSI для стандартизации процесса извлечения РП и предварительной обработки изображений предлагают использовать свои радиомические фантомы. В их руководстве представлены эталонные РП [4, 36].
P. Lambin и соавт. (2016) создали два цифровых фантома, которые включают 90 ROI с различными текстурами и морфологиями, и рассчитали для них эталонные радиомические показатели в пяти разных программах. Фантомы ImSURE, созданные в этой работе, доступны в «ImSURE Phantoms» на Figshare [37].
Извлечение радиомических характеристик.
После сегментации с помощью платформ для текстурного анализа извлекают РП. Существует много различных платформ для текстурного анализа, однако их надежность значительно варьирует, в том числе и в зависимости от версии программного обеспечения.
Использование платформ, одобренных Инициативой по стандартизации биомаркеров изображений (IBSI): PyRadiomics [35], LIFEx [38] и CERR [39], повышает надежность радиомических показателей на разных платформах, но только при согласовании настроек [40].
Существует множество различных способов и формул для расчета РП, рекомендуется придерживаться рекомендаций IBSI [4, 14, 20]. Как уже было написано ранее, IBSI стремятся стандартизировать номенклатуру текстурных показателей. На данный момент стандартизировано 169 признаков [4].
Радиомические признаки можно классифицировать в следующие группы [4, 41]:
1. Характеристики формы (только для 3D-анали- за): объем, максимальный 3D-диаметр, компактность, сферичность и т.д.
2. Текстурные показатели (наиболее востребова-ны в радиомике):
— Статистические признаки первого порядка — оценивается распределение значений отдельных вокселей без учета пространственных отношений, они обычно основаны на гистограммах): среднее значение (средняя интенсивность), энтропия, куртозис и асимметрия.
— Статистические признаки второго порядка — оценивается пространственное распределение пикселей или вокселей. Некоторые из часто используе-мых признаков 2-го порядка: Grey-Level Run Length Matrix (GLRLM), Grey-Level Zone Length Matrix (GLZLM), Grey Level Cooccurrence Matrix (GLCM) Neighborhood Grey-Level Difference Matrix (NGLDM) и т.д.
— Статистические признаки высшего порядка получают после применения фильтров (the Laplacian of Gaussian (LoG), Wavelet, Fourier trans¬form и др.).
Параметрические карты радиомических признаков — визуально представленные значения радиомических признаков, то есть каждому вокселю на изображении соответствует какое-либо значение РП. С помощью карт исследователи могут визуаль¬но анализировать данные, что важно для клинического применения радиомики [42].
D. Kim и соавт. (2021) представили свой инструмент для создания параметрических карт. Основной принцип заключается в расчете карт для всего изображения (обычно РП в радиомике рассчитывают для сегментированной области) путем его разделения на воксели фиксированного размера. Каждый признак рассчитывается для отдельных вокселей изображения, а не для всего ROI [42].
Обработка РП.
При анализе изображений выде-ляют большое количество показателей, следующим этапом необходимо выбрать часть из них для включения в модель. Избыточность, повторение, неоднозначность полученных признаков могут привести к созданию неправильно обученной радиомической модели, которая не будет воспроизводима с новыми данными. Чтобы этого избежать, необходимо прове¬сти предварительную обработку РП до обучения радиомической модели. Существуют такие методы предварительной обработки признаков, как:
1) нормализация или гармонизация РП;
2) повторная выборка признаков [43];
3) удаление повторяющихся и избыточных при-знаков [7];
4) замена пропущенных значений (imputation) [44];
5) отбор признаков для данной задачи [7, 21].
Не существует универсального метода обработки признаков. Наилучшей комбинацией на самом деле является та, которая лучше всего подходит для решения конкретной рассматриваемой проблемы. По этой причине этап предварительной обработки признаков трудно стандартизировать, и обычно исследователь эмпирически обрабатывает данные, что затрудняет объективную оценку принятого подхода. Поэтому необходима тщательная проверка результатов радиомического анализа и точное описание процесса [43].
Создание радиомической модели. На этом этапе крайне важно разделить набор данных на две группы:
1) для обучения, используется для разработки радиомической модели;
2) для тестирования, чтобы точно настроить модель.
Переобучение (overfitting) происходит, когда
при обучении модели используются не только специфичные для патологии характеристики, но также характеристики, полученные из-за шума изображения и артефактов. Чтобы избежать переобучения, необходим этап предварительной обработки данных. Проверка с использованием отдельного набора данных помогает обнаружить переобучение. Переобученная модель будет работать на тестовом наборе данных, а на проверочном — нет [3].
Недостаточное обучение (underfitting) воз¬можно при использовании небольшого количества данных. Такая модель не способна правильно классифицировать данные [3].
Классификация радиомических моделей
По цели:
1. диагностические (определение степени злока-чественности [32], дифференциальная диагностика [29], обнаружение образований);
2. прогностические (прогнозирование выживае-мости [46], ответа на терапию [29, 33], метастазиро- вания [47], инвазии [1], рецидива, малигнизации, оценка резектабельности).
По направлению:
1. классическая радиомика;
2. delta-радиомика [48];
3. habitat-радиомика [49];
4. fusion-радиомика:
— слияние изображений;
— мультиомика (комбинирование радиомики и геномики, эпигеномики, транскриптомики, протеомики, метаболомики) [1, 50];
— создание комбинированных клинически- радиомических моделей [8, 32, 49] и др.
По типу обработки данных:
1) классическая радиомика с применением ста-тистической обработки;
2) радиомика с применением методов машинного обучения;
3) радиомика с применением глубокого машин-ного обучения.
После выбора функций можно разработать диаг-ностическую модель с помощью различных класси-фикаторов для прогнозирования заранее определенного результата, например гистологической дифференцировки, генетического подтипа или молекулярного профиля опухоли. Также можно создать прогностическую модель какого-либо события, в том числе, рецидива или метастазирования опухо¬ли или изменений тканей (ответа) на фоне лечения (дельта-радиомика). Наиболее часто используемые классификаторы в радиомике для машинного обуче-ния: XG Boost (XGB), Random Forest (RF), Support Vector Machine (SVM), K-SVM, K-nearest neighbor, Logistic Regression, Naive Bayes, Decision Tree [22].
С использованием этих классификаторов создают радиомические модели и отбираются наиболее эффективные из них. Также возможно создание моделей с несколькими классификаторами, что может повышать точность моделей [41].
Как было сказано ранее, можно создавать радио- мические модели, в которых клинические данные или КТ-характеристики объединены с текстурными показателями (комбинированные радиомические модели).
В комбинированных моделях могут быть использованы как общие признаки, так и морфологические или типичные КТ-признаки (пол, возраст, диаметр, расположение опухоли, паттерн роста, изъязвление, наличие воздуха в образовании, окружающая жировая клетчатка, край опухоли, форма опухоли, прорастание в прилежащие органы, плотность, кальцификация, внутриопухолевое кровоизлияние, видимые сосуды в опухоли, некроз, расширенные сосуды вокруг опухоли, характер контрастирования, лимфа- денопатия, метастазы в печень). Во многих изученных исследованиях тестировали клинические, радиомические и комбинированные модели и отбирали наиболее эффективные. Именно комбинированные модели имели наибольшую эффективность [8, 32, 49].
Также возможно использование в комбинированных диагностических моделях молекулярных маркеров образований [1]. Это направление называют «мультиомика» (может включать в себя такие направления, как геномика, эпигеномика, транскриптомика, протеомика, метаболомика).
Объединение данных в радиомике — это перспективное направление, так как при большом количестве данных может формироваться более целостная картина конкретного образования, что ведет к персонифицированному подходу в диагностике и лечении заболеваний.
Радиомика перитуморальных тканей показывает многообещающие результаты. В исследовании H. Chu и соавт. (2021) для прогнозирования рецидива опухоли были разработаны радиомические модели, основанные на клинических факторах. Для прогнозирования раннего рецидива комбинированная радиомически-клиническая модель с выделением опухоли и 5 мм перитуморальной области показала наивысшую эффективность (AUC 0,805). Для прогнозирования позднего рецидива радиомическая модель внутриопухолевой области имела оптимальные показатели с AUC 0,735. Модель на основе только клинических факторов показала более низкие показатели с АUC 0,598. Для прогнозирования как ранних, так и поздних рецидивов все оптимальные модели были построены с использованием радиомических признаков опухолевой и перитуморальной областей [1, 26].
Для оценки результатов лечения применяют дельтарадиомику. Для этого РП вычисляют из изображений, полученных до и после терапии, и разрабатывают радиомическую модель, которая оценивает изменения РП, возникшие после лечения [48].
Habitat-радиомика — область радиомики, в которой опухоль сегментируется на субрегионы для оценки гетерогенности опухоли. Гетерогенность образования (опухолевые клоны и микроокружение опухоли) может способствовать резистентности опухоли к лечению, прогрессированию опухоли и низкой выживаемости пациентов [49]. Оценка гетеро-енности опухоли может повысить точность прогностических и диагностических моделей, с помощью habitat-радиомики можно выбрать оптимальную область для проведения биопсии, так как согласно одному из исследований [49] результаты habitat- радиомики коррелируют с гистологией (гетероген-ность соответствует областям некроза, фиброза, повышенной плотности, сосудам).
Применение радиомических моделей в клинической практике.
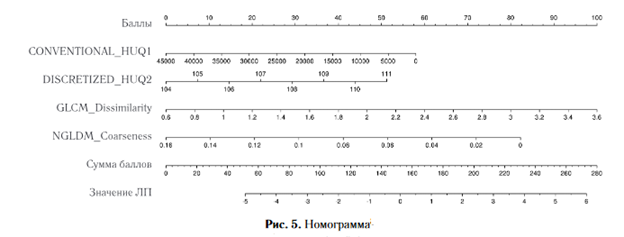
Номограммы — графически пред¬ставленные радиомические модели, используются для
прогнозирования вероятности того или иного результата. Обычно представлены в
виде графиков с несколькими шкалами, каждая из которых соответствует
радиомической характеристике.
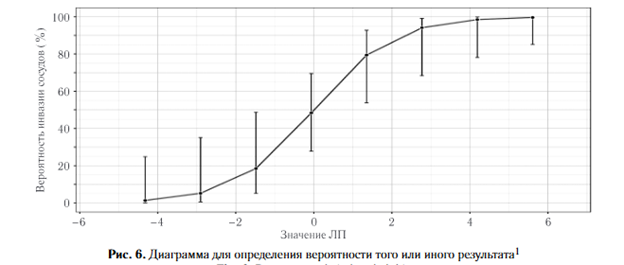
1. После получения радиомических показателей, подставляют значения РП в разработанные номограммы (рис. 5). По сумме баллов предикторов получают значение линейного предиктора (ЛП).
2. В зависимости от значений линейного предик¬тора с помощью диаграмм, разработанных для каждой модели, определяют вероятность того или иного результата1 2 3 (рис. 6).
Для более быстрой работы с разработанными моделями в НМИЦ хирургии им. А. В. Вишневского были созданы онлайн-калькуляторы:
— для предоперационного определения степени дифференцировки протоковой аденокарциномы поджелудочной железы (ПАПЖ)2,3;
— для предоперационной дифференциальной диаг¬ностики ПАПЖ с псевдотуморозным панкреатитом4;
Дипрадиомика.
Дипрадиомика — направление радиомики, в котором осуществляется применение технологий глубокого машинного обучения на раз-личных этапах построения радиомической модели.
Глубокое обучение (DL) — подтип машинного обучения, работающий на основе алгоритмов, создан¬ных по типу нейронов человеческого мозга. Сверточная нейронная сеть (convolutional neural network, CNN) — самый популярный тип глубокого обучения для анализа медицинских изображений. Использовать глубокое машинное обучение можно как на отдельных этапах оценки изображений (сег-ментация, получение признаков из изображений, улучшение качества изображений или разработка диагностической модели на основе классификаторов), так и для всего процесса создания диагностической модели [7]. В данном разделе мы рассмотрим некоторые возможности применения глубокого машинного обучения в радиомике.
— для предоперационной оценки результатов неоадъювантного лечения (определение регресса опухоли и вероятности врастания опухоли в стенку магистральных сосудов)5;— для оценки вероятности наличия нейроэндо-кринных опухолей G 2/36;
— для предоперационного прогнозирования сте-пени гистологической дифференцировки и для диф-ференциальной диагностики гиперваскулярных образований печени7.
Гармонизация изображений.
M. Zarei и соавт. (2023) обучили нейронную сеть «гармонизировать» изображения. Они получили изображения фантомов с различными эффектами сканирования (шум, размытие, артефакты) и без них. Изображения, полученные при разных условиях сканирования, гармонизировали и сравнивали их с основным эталонным изображением (без шума, размытия и арте-фактов). В результате метод обеспечил единообразие входных данных, снижение вариабельности текстурных показателей, основанных на плотности, однако не повлиял на морфологические текстурные показатели [12].
Y. Zhang и соавт. (2020) [46] использовали CNN, которая была предварительно обучена на изображе-ниях немелкоклеточного рака легкого (422 пациентов), для построения своей прогностической модели
Автоматическая сегментация. Как указано в разделе «Сегментация», для автоматической сегментации в медицинской визуализации наиболее часто используют модель U-net [22-24].
Нормализация радиомических признаков.
V. Andrearczyk и соавт. (2019) использовали фантом для обучения нейронной сети нормализации РП. Использование фантома позволяет CNN провести контролируемый анализ, выявить отклонения в работе сканера, исключить РП, связанные с этим и при оценке изображений пациента выявить значимые и воспроизводимые РП [17].
PML (методы машинного обучения на основе пикселей) используют значения пикселей/вокселей в изображениях вместо текстурных признаков, извлеченных из сегментированных изображений. Таким образом, устраняется необходимость в сегментации, одном из основных источников изменчивости радиомических характеристик. Кроме того, не нужно удалять часть признаков (как при обычном текстурном анализе на этапе отбора ТП), следовательно, нет связанной с этим статистической погрешности [7].
Transfer learning. Вместо самостоятельного обучения моделей можно дообучать уже существую-щие (например, ResNet, VGG и др.) [7]. Такой под-ход называется transfer learning. Преимущество transfer learning в том, что возможно использовать 1
выживаемости при аденокарциноме поджелудочной железы (68 пациентов). Предложенная модель была более эффективна, в сравнении с традиционной радиомической моделью (модель на основе CNN имела более высокий IPA/индекс точности прогнозирования (11,89% против 4,40%).
Важно отметить, что нейронные сети необходимо обучать на большом объеме данных. Либо нужно использовать методы для увеличения количества данных (например, пертурбацию («искажение») и аугментацию данных [7]).
Результаты. Обзор данных литературы по радио- мике КТ-изображений новообразований органов брюшной полости, выполненный нами, продемон¬стрировал высокую актуальность и перспективность данного направления.
Радиомика может использоваться в медицине для решения ряда клинических и научных задач, диффе-ренциальной диагностики патологических процес-сов, определения стадии, гистологического, молеку-лярного, генетического профиля образований, про-гнозирования ответа на лечение, мониторинга забо-левания, определения персонализированной тактики ведения пациента.
Проблемы применения радиомики в клиниче¬ской практике. Несмотря на потенциал радиомики, она все еще не получила широкого распространения в клинической практике. Одной из причин является отсутствие профильного образования и подготовки специалистов в этой области. Рентгенологи обычно не имеют достаточных знаний и навыков для работы с методами радиомики, поэтому необходимо создание образовательных программ и специализированных отделов в научных и учебных учреждениях.
Проблема «черного ящика» (проблема интерпретации результатов) в радиомике возникает из-за того, что для анализа изображений используют сложные математические модели, которые вклю¬чают в себя большое количество данных. Не всегда можно объяснить и проверить результаты работы таких моделей [10].
Как мы уже писали ранее, надежность результатов радиомики зависит от используемых данных. Создание единых баз медицинских данных по всей стране или даже по всему миру, обмен данными между институтами и медицинским организациями важны для развития диагностики, основанной на радиомике, машинном обучении, для персонали-зированного лечения пациентов [7]. Однако это требует преодоления определенных технических, юридических и этических проблем. Так, при работе с медицинскими данными необходимо помнить о конфиденциальности данных пациентов. Для решения этой проблемы можно использовать шифрование, анонимизацию данных, ограничение доступа к базе данных, обучение сотрудников [7, 36, 56].
Наконец, мы считаем, что радиомика является лишь одним из инструментов в арсенале современного врача. Она должна использоваться в сочетании с другими методами диагностики, такими как традиционная визуализация, биопсия и молекулярные исследования. Комплексный подход к диагностике позволит максимально эффективно использовать потенциал радиомики.
Заключение.
Таким образом, радиомика — многообещающее направление, которое требует дальнейших исследований, образования и междисциплинарного сотрудничества для успешного внедрения в клиническую практику. Мы уверены, что с развитием технологий и накоплением опыта в этой обла¬сти радиомика сможет занять достойное место в медицине.
Сведения об авторах:
Кондратьев Евгений Валерьевич — кандидат медицинских наук, старший научный сотрудник отделения рентгенологии и магнитно-резонансных исследований федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр хирургии имени А. В. Вишневского» Министерства здравоохранения Российской Федерации; 117997, Москва, Большая Серпуховская ул., д. 27; ORCID 0000-0001-7070-3391;
Шмелева София Антоновна — врач-ординатор отделения рентгенологии и магнитно-резонансных исследований федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр хирургии имени А. В. Вишневского» Министерства здравоохранения Российской Федерации; 117997, Москва, Большая Серпуховская ул., д. 27; ORCID 0009-0007-5724-2763;
Усталов Андрей Александрович — младший научный сотрудник отделения рентгенологии и магнитно-резонансных исследований федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр хирургии имени А. В. Вишневского» Министерства здравоохранения Российской Федерации; 117997, Москва, Большая Серпуховская ул., д. 27; ORCID 0009-0005-9267-8584;
Гурина Вера Ивановна — кандидат медицинских наук, научный сотрудник отделения рентгенологии и магнитно-резонансных исследований федерального госу-дарственного бюджетного учреждения «Национальный медицинский исследовательский центр хирургии имени А. В. Вишневского» Министерства здравоохра-нения Российской Федерации; 117997, Москва, Большая Серпуховская ул., д. 27; ORCID 0000-0002-1015-3890;
Кармазановский Григорий Григорьевич\ — доктор медицинских наук, профессор, академик РАН, заведующий отделом лучевых методов диагностики и лечения федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр хирургии имени А. В. Вишневского» Министерства здравоохранения Российской Федерации; 117997, Москва, Большая Серпуховская ул., д. 27; профессор кафедры лучевой диагностики и терапии медико-биологического факультета федерального государственного автономного образовательного учреждения высшего образования «Российский националь-ный исследовательский медицинский университет имени Н. И. Пирогова» Министерства здравоохранения Российской Федерации; 117997, Москва, ул. Островитянова, д. 1; ORCID 0000-0002-9357-0998; SPIN 5964-2369.
ЛИТЕРАТУРА
1. Смирнова А.Д., Кармазановский Г.Г., Кондратьев Е.В., Карельская Н.А., Галкин В.Н., Попов А.Ю., Гурмиков Б.Н., Калинин Д.В. Радиомика и радиогеномика при внутрипеченочной холангиокарциноме // Research’n and Practical Medicine Journal. 2024. Т. 11 № 1. С. 54-69. [Smirnova A.D., Karmazanovsky G.G., Kondratyev E.V., Karelskaya N.A., Galkin V.N., Popov A.Yu., Gurmikov B.N., Kalinin D.V. Radiomics and radiogenomics in intrahepatic cholangiocarcinoma. Research and Practical Medicine Journal, 2024, Vol. 11, No. 1, рр. 54-69 (In Russ.)]. doi: 10.17709/2410-1893-2024-11-1-5. EDN: TLBFTQ.
2. Karmazanovsky G., Gruzdev I., Tikhonova V. et al. Computed tomography-based radiomics approach in pancreatic tumors characterization // Radiol. Med. 2021. Vol. 126. P. 1388-1395. doi: 10.1007/s11547-021-01405-0.
3. Mayerhoefer M.E., Materka A., Langs G., Haggstrom I., Szczypinski P., Gibbs P., Cook G. Introduction to Radiomics // J. Nucl. Med. 2020. Vol. 61, No. 4. P. 488¬495. doi: 10.2967/jnumed.118.222893.
4. Zwanenburg A., Vallieres M., Abdalah et al. The Image Biomarker Standardization Initiative: Standardized Quantitative Radiomics for High-Throughput Image-based Phenotyping // Radiology. 2020. Vol. 295, ^. 2. P. 328-338. doi: 10.1148/radiol.2020191145.
5. Jha A.K., Mithun S., Jaiswar V., Sherkhane U.B., Purandare N.C., Prabhash K., Rangarajan V., Dekker A., Wee L., Traverso A. Repeatability and reproducibility study of radiomic features on a phantom and human cohort // Sci Rep. 2021. Vol. 11. doi: 10.1038/s41598-021-81526-8.
6. Clark K., Vendt B., Smith K., Freymann J., Kirby J., Koppel P., Moore S., Phillips S., Maffitt D., Pringle M., Tarbox L., Prior F. The Cancer Imaging Archive (TCIA): maintaining and operating a public information repository // J. Digit Imaging. 2013. Vol. 26, No. 6. P. 1045-1057. doi: 10.1007/s10278-013-9622-7.
7. Avanzo M., Wei L., Stancanello J., Vallieres M., Rao A., Morin O., Mattonen S.A., El Naqa I. Machine and deep learning methods for radiomics // Med. Phys. 2020. Vol. 47, No. 5. P. 185-202. doi: 10.1002/mp.13678.
8. Wang Y., Wang Y., Ren J., Jia L., Ma L., Yin X., Yang F., Gao B.L. Malignancy risk of gastrointestinal stromal tumors evaluated with noninvasive radiomics: A multi-center study // Front Oncol. 2022. Vol. 12. doi: 10.3389/fonc.2022.966743.
9. Кармазановский Г.Г., Шантаревич М.Ю., Сташкив В.И., Ревишвили А.Ш. Воспроизводимость текстурных показателей КТ- и МРТ-изображений гепатоцеллю- лярного рака // Медицинская визуализация. 2023. Т. 27, № 3. С. 84-93. [Kаrmаzаnovsky G.G., Shantarevich M.Y., Stashkiv V.I., Revishvili A.Sh. Reproducibility of CT and MRI texture features of hepatocellular carcinoma. Medical Visualization, 2023, Vol. 27, No. 3, рр. 84-93 (In Russ.)]. doi: 10.24835/1607-0763-1372.
10. Замятина К.А., Годзенко М.В., Кармазановский ГГ, Ревишвили А.Ш. Радиомика при заболеваниях печени и поджелудочной железы. Обзор литературы // Анналы хирургической гепатологии. 2022. Т. 27, № 1. С. 40-47. [Zamyatina K.A., Godzenko M.V., Kаrmаzаnovsky G.G., Revishvili A.Sh. Radiomics in liver and pancreatic disorders: a review. Annals of Surgical Hepatology, 2022, Vol. 27, No. 1, рр. 40-47 (In Russ.)]. doi: 10.16931/1995-5464.2022-1-40-47.
11. Zarei M., Sotoudeh-Paima S., McCabe C., Abadi E., Samei E. Harmonizing CT Images via Physics-based Deep Neural Networks // Proc. SPIE Int. Soc. Opt. Eng. 2023; doi: 10.1117/12.2654215.
12. Singh A., Horng H., Chitalia R., Roshkovan L., Katz S.I., Noel P., Shinohara R.T., Kontos D. Resampling and harmonization for mitigation of heterogeneity in image parameters of baseline scans // Sci Rep. 2022. Vol. 12, No. 1. doi: 10.1038/s41598-022-26083-4.
13. Mali S.A., Ibrahim A., Woodruff H.C., Andrearczyk V., Muller H., Primakov S., Salahuddin Z., Chatterjee A., Lambin P. Making Radiomics More Reproducible across Scanner and Imaging Protocol Variations: A Review of Harmonization Methods // J. Pers. Med. 2021. Vol. 11, No. 9. doi: 10.3390/jpm11090842.
14. Refaee T., Salahuddin Z., Widaatalla Y., Primakov S., Woodruff H.C., Hustinx R., Mottaghy F.M., Ibrahim A., Lambin P. CT Reconstruction Kernels and the Effect of Pre- and Post-Processing on the Reproducibility of Handcrafted Radiomic Features // J. Pers. Med. 2022. Vol. 12, No. 4. doi: 10.3390/jpm12040553.
15. Ramli Z., Farizan A., Tamchek N., Haron Z., Abdul Karim M.K. Impact of Image Enhancement on the Radiomics Stability of Diffusion-Weighted MRI Images of Cervical Cancer // Cureus. 2024. Vol. 16, No. 1. doi: 10.7759/cureus.52132.
16. Deng H., Deng W., Sun X., Liu M., Ye C., Zhou X. Mammogram Enhancement Using Intuitionistic Fuzzy Sets // IEEE Transactions on Biomedical Engineering. Vol. 64, No. 8. P. 1803-1814. 2017. doi: 10.1109/TBME.2016.2624306.
17. Andrearczyk V., Depeursinge A., Muller H. Neural network training for cross-protocol radiomic feature standardization in computed tomography // J. Med. Imaging. (Bellingham). 2019 Vol. 6, No. 2. Р 024008. doi: 10.1117/1.JMI.6.2.024008.
18. Ligero M., Jordi-Ollero O., Bernatowicz K., Garcia-Ruiz A., Delgado-Munoz E., Leiva D., Mast R., Suarez C., Sala-Llonch R., Calvo N., Escobar M., Navarro- Martin A., Villacampa G., Dienstmann R., Perez-Lopez R. Minimizing acquisition-related radiomics variability by image resampling and batch effect correction to allow for large-scale data analysis // Eur. Radiol. 2021. Vol. 31, No. 3. Р 1460-1470. doi: 10.1007/s00330-020-07174-0.
19. Deng Y., Yang D., Tan X., Xu H., Xu
L., Ren A., Liu P., Yang Z. Preoperative evaluation of microvascular invasion
in hepatocellular carcinoma with a radiological fea-ture-based nomogram: a
bi-centre study // BMC Med Imaging. 2024. Vol. 24, No. 1. Р 29. doi:
10.1186/s12880-024-01206-7.
20. Zhao H., Feng Z., Li H., Yao S., Zheng W., Rong P. Influence of different region of interest sizes on CT-based radiomics model for microvascular invasion prediction in hepatocellular carcinoma // Zhong Nan Da Xue Xue Bao Yi Xue Ban. 2022. Vol. 47, No. 8. P. 1049-1057. English, Chinese. doi: 10.11817/j.issn. 1672-7347.2022.220027.
21. Van Timmeren J.E., Cester D., Tanadini-Lang S., Alkadhi H., Baessler B. Radiomics in medical imaging-»how-to» guide and critical reflection // Insights Imaging. 2020. Vol. 11, No. 1. doi: 10.1186/s13244-020-00887-2.
22. Tharmaseelan H., Vellala A.K., Hertel A., Tollens F., Rotkopf L.T., Rink J., Woznicki P., Ayx I., Bartling S., Norenberg D., Schoenberg S.O., Froelich M.F. Tumor classification of gastrointestinal liver metastases using CT-based radiomics and deep learning // Cancer Imaging. 2023. Vol. 23, No. 1. doi: 10.1186/s40644-023- 00612-4.
23. Stuber A.T., Coors S., Schachtner B., Weber T., Rugamer D., Bender A., Mittermeier A., Ocal O., Seidensticker M., Ricke J., Bischl B., Ingrisch M. A Comprehensive Machine Learning Benchmark Study for Radiomics-Based Survival Analysis of CT Imaging Data in Patients With Hepatic Metastases of CRC // Invest Radiol. 2023. Vol. 58, No. 12. P. 874-881. doi: 10.1097/RLI.0000000000001009.
24. Zhu H., Wu M., Wei P., Tian M., Zhang T., Hu C., Han Z. A modified method for CT radiomics region-of-interest segmentation in adrenal lipid-poor adenomas: a two-institution comparative study // Front. Oncol. 2023. Vol. 13. doi: 10.3389/fonc.2023.1086039.
25. Fiz F., Rossi N., Langella S., Ruzzenente A., Serenari M., Ardito F., Cucchetti A., Gallo T., Zamboni G., Mosconi C., Boldrini L., Mirarchi M., Cirillo S., De Bellis M., Pecorella I., Russolillo N., Borzi M., Vara G., Mele C., Ercolani G., Giuliante F., Ravaioli M., Guglielmi A., Ferrero A., Sollini M., Chiti A., Torzilli G., leva F., Vigano L. Radiomic Analysis of Intrahepatic Cholangiocarcinoma: Non-Invasive Prediction of Pathology Data: A Multicenter Study to Develop a Clinical-Radiomic Model // Cancers (Basel). 2023. Vol. 15 No. 17. doi: 10.3390/cancers15174204.
26. Chu H., Liu Z., Liang W., Zhou Q.,
Zhang Y., Lei K. et al. Radiomics using CT images for preoperative prediction
of futile resection in intrahepatic cholangiocarci¬noma // Eur. Radiol. 2021.
Vol. 31, No. 4. P. 2368-2376.
27. Gao Y., Wang X., Zhao X., Zhu C., Li
C., Li J., Wu X. Multiphase CT radiomics nomogram for preoperatively predicting
the WHO/ISUP nuclear grade of small (<4 cm) clear cell renal cell carcinoma
// BMC Cancer. 2023. Vol. 23, No. 1. Р 953.
28. Negreros-Osuna A.A., Ramirez-Mendoza D.A., Casas-Murillo C., Guerra-Cepeda A., Hernandez-Barajas D., Elizondo-Riojas G. Clinical-radiomic model in advanced kidney cancer predicts response to tyrosine kinase inhibitors // Oncol Lett. 2022. Vol. 24, No. 6. doi: 10.3892/ol.2022.13566.
29. Li Y., Li J., Meng M., Duan S., Shi H., Hang J. Development and Validation of a Radiomics Nomogram for Liver Metastases Originating from Gastric and Colorectal Cancer // Diagnostics (Basel). 2023. Vol. 13, No. 18. doi: 10.3390/diagnostics13182937.
30. Huang L., Feng W., Lin W., Chen J., Peng S., Du X., Li X., Liu T., Ye Y. Enhanced and unenhanced: Radiomics models for discriminating between benign and malig¬nant cystic renal masses on CT images: A multi-center study // PLoS One. 2023. Vol. 18, No. 9. PMID: 37768941; PMCID: PMC10538730. doi: 10.1371/journal.pone.0292110.
31. Fedorov A., Beichel R., Kalpathy-Cramer J., Finet J., Fillion-Robin J.C., Pujol S., Bauer C., Jennings D., Fennessy F., Sonka M., Buatti J., Aylward S., Miller J.V., Pieper S., Kikinis R. 3D Slicer as an image computing platform for the Quantitative Imaging Network // Magn. Reson. Imaging. 2012. Vol. 30, No. 9. doi: 10.1016/j.mri.2012.05.001.
32. Xue G., Liu H., Cai X., Zhang Z., Zhang S., Liu L., Hu B., Wang G. Impact of deep learning image reconstruction algorithms on CT radiomic features in patients with liver tumors // Front Oncol. 2023. Vol. 13. doi: 10.3389/fonc.2023.1167745.
33. Cappello G., Giannini V., Cannella R., Tabone E., Ambrosini I., Molea F., Damiani N., Landolfi I., Serra G., Porrello G., Gozzo C., Incorvaia L., Badalamenti G., Grignani G., Merlini A., D'Ambrosio L., Bartolotta T.V., Regge D. A mutation-based radiomics signature predicts response to imatinib in Gastrointestinal Stromal Tumors (GIST) // Eur. J. Radiol. Open. 2023. Vol. 11. doi: 10.1016/j.ejro.2023.100505.
34. Larue R.T.H.M., van Timmeren J.E., de Jong E.E.C., Feliciani G., Leijenaar R.T.H., Schreurs W.M.J.,Lambin P. Influence of gray level discretization on radiomic feature stability for different CT scanners, tube currents and slice thicknesses: a comprehensive phantom study // Acta Oncologica. 2017. Vol. 56, No. 11. P. 1544¬1553. doi: 10.1080/0284186X.2017.1351624.
35. Van Griethuysen J.J.M., Fedorov A., Parmar C., Hosny A., Aucoin N., Narayan V., Beets-Tan R.G.H., Fillon-Robin J.C., Pieper S., Aerts H.J.W.L. Computational Radiomics System to Decode the Radiographic Phenotype // Cancer Research. 2017. Vol. 77, No. 21. P. 104-107. doi: 10.1158/0008-5472.CAN-17-0339.
36. Rizzo S., Botta F., Raimondi S., Origgi D., Fanciullo C., Morganti A.G., Bellomi M. Radiomics: the facts and the challenges of image analysis // Eur. Radiol. Exp. 2018. Vol. 2, No. 1. doi: 10.1186/s41747-018-0068-z.
37. Bettinelli A., Marturano F. ImSURE Phantoms. figshare // Collection. 2022. doi: 10.6084/m9.figshare.c.5625439.v2.
38. Nioche C., Orlhac F., Boughdad S., Reuze S., Goya-Outi J., Robert C., Pellot-Barakat C., Soussan M., Frouin F., Buvat I. LIFEx: A freeware for radiomic feature calculation in multi- modality imaging to accelerate advances in the characterization of tumor heterogeneity // Cancer Res. 2018; Vol. 78, No. 16. P. 4786-4789. 10.1158/0008-5472.CAN-18-0125.
39. Deasy J.O., Blanco A.I., Clark V.H. CERR: a computational environment for radiotherapy research // Med. Phys. 2003. Vol. 30, No. 5. P. 979-985. doi: 10.1118/1.1568978.
40. Fornacon-Wood I., Mistry H., Ackermann
C.J. et al. Reliability and prognostic value of radiomic features are highly
dependent on choice of feature extraction platform // Eur. Radiol. 2020. Vol.
30. P. 6241-6250.
41. Fahmy D., Alksas A., Elnakib A., Mahmoud A., Kandil H., Khalil A., Ghazal M., van Bogaert E., Contractor S., El-Baz A. The Role of Radiomics and AI Technologies in the Segmentation., Detection., and Management of Hepatocellular Carcinoma // Cancers (Basel). 2022. Vol. 14 No. 24. doi: 10.3390/cancers14246123.
42. Kim D., Jensen L.J., Elgeti T., Steffen I.G., Hamm B., Nagel S.N. Radiomics for Everyone: A New Tool Simplifies Creating Parametric Maps for the Visualization and Quantification of Radiomics Features // Tomography. 2021. Vol. 7, No. 3. P. 477-487. doi: 10.3390/tomography7030041.
43. Stanzione., Arnaldo et al. Oncologic Imaging and Radiomics: A Walkthrough Review of Methodological Challenges // Cancers. 2022. Vol. 14, No. 19. doi: 10.3390/cancers14194871.
44. Huang L., Song M., Shen H., Hong H., Gong P., Deng H.W., Zhang C. Deep Learning Methods for Omics Data Imputation // Biology (Basel). 2023. Vol. 12 No 10. doi: 10.3390/biology12101313.
45. Chung Y.E., Kim M.J., Park Y.N., Choi J.Y., Pyo J.Y., Kim Y.C. et al. Varying appearances of cholangiocarcinoma: radiologic-pathologic correlation // Radiographics. 2009. Vol. 29 No. 3. P. 683-700. doi: 10.1148/rg.293085729.
46. Zhang Y., Lobo-Mueller E.M., Karanicolas P., Gallinger S., Haider M.A., Khalvati F. CNN-based survival model for pancreatic ductal adenocarcinoma in medical imaging // BMC Med. Imaging. 2020. Vol. 20 No. 1.
47. Li M., Zhu Y.Z., Zhang Y.C., Yue Y.F., Yu H.P., Song B. Radiomics of rectal cancer for predicting distant metastasis and overall survival // World J. Gastroenterol. 2020. Vol. 26 No. 33. doi: 10.3748/wjg.v26.i33.5008.
48. Nardone V., Reginelli A., Grassi R.,
Boldrini L., Vacca G., D'Ippolito E., Annunziata S., Farchione A., Belfiore M.P.,
Desideri I., Cappabianca S. Delta radiomics: a systematic review // Radiol Med.
2021. Vol. 126 No. 12. P. 1571-1583.
49. Prior O., Macarro C., Navarro V., Monreal C., Ligero M., Garcia-Ruiz A., Serna G., Simonetti S., Brana I., Vieito M., Escobar M., Capdevila J., Byrne A.T., Dienstmann R., Toledo R., Nuciforo P., Garralda E., Grussu F., Bernatowicz K., Perez-Lopez R. Identification of Precise 3D CT Radiomics for Habitat Computation by Machine Learning in Cancer // Radiol Artif Intell. 2024. Vol. 6, No. 2. doi: 10.1148/ryai.230118.
50. Wei L., Niraula D., Gates E.D.H., Fu J., Luo Y., Nyflot M.J., Bowen S.R., El Naqa I.M., Cui S. Artificial intelligence (AI) and machine learning (ML) in precision oncology: a review on enhancing discoverability through multiomics integration // Br. J. Radiol. 2023. Vol. 96, No. 1150. doi: 10.1259/bjr.20230211.
Теги: брюшная полость
234567 Начало активности (дата): 24.05.2025
234567 Кем создан (ID): 989
234567 Ключевые слова: радиомика, текстурный анализ, брюшная полость, поджелудочная железа, печень, ГИСО, метастазы
12354567899
Похожие статьи
Исторические аспекты становления и развития методов лучевой диагностики в перинатологииРентген на дому 8 495 22 555 6 8
Новый рентген-аппарат появился в клинической больнице Ленинского округа
Исследования показали большую опухоль с признаками распада и межкишечным абсцессом
Переломы бедренной кости (кроме проксимального отдела бедренной кости)



