 02.12.2025
02.12.2025
“Матовое стекло” - от наблюдения к действию. Современный арсенал диагностики периферических очаговых образований в легких по типу “матового стекла”
Представлены результаты эффективности бронхоскопии с различными вариантами бронхобиопсий под КТ-контролем в режиме флюороскопии с предварительной КТ-навигацией в диагностике периферических очагов в легких по типу “матового стекла"
Введение
Компьютерная томография (КТ) является методом выбора первой линии при исследовании очаговых образований легких [1]. Ее роль особенно возросла после введения в практику контрастных средств, которые повышают качество изображений и дают более полный спектр информации [2, 3]. Тем не менее все еще не до конца решен вопрос дифференциальной диагностики округлых образований легких, в частности очагов по типу “матового стекла”, ключевым моментом в отношении которых является вопрос о злокачественности процесса.
Выявляемость небольших очаговых образований легких ввиду широкого применения КТ увеличилась. В РФ и других странах существует ряд алгоритмов диагностики при выявлении очагов в легких, такие как методические рекомендации по скринингу рака легкого, Lung Imaging Reporting and Data System (Lung-RADS 1.1), рекомендации Флейшнеровского сообщества по анализу случайно выявленных легочных очагов, тактика ведения очагов в легких Британского торакального общества [4-7]. Представленные алгоритмы ориентируются только на размер и структуру очага, предлагают динамическое наблюдение для ряда пациентов. Однако при наличии онкологического процесса наблюдение и затягивание начала лечения ведут к росту стадии заболевания на момент окончательной диагностики и, соответственно, ухудшению выживаемости больных [8].
Очаги по типу “матового стекла” встречаются реже в сравнении с солидными и субсолидными очагами, однако потенциально более злокачественны [9]. По данным КТ очаги по типу “матового стекла” включают широкий спектр различных патологических состояний - от воспаления до рака легкого, могут являться различными вариантами аденокарцином (атипичная аденоматозная гиперплазия, аденокарцинома in situ: немуцинозная, муцинозная, со стелющимся типом роста (lepidic), ацинарная, папиллярная, микропапиллярная, солидная, инвазивная муцинозная, смешанная инвазивная муцинозная и немуцинозная, коллоидная, фетальная, кишечного типа). Так, атипическая аденоматозная гиперплазия визуализируется преимущественно в виде “матового стекла”, имеет овальную или округлую форму, чаще менее 5 мм в диаметре, редко более 10 мм.Очаги атипичной аденоматозной гиперплазии могут быть одиночными, но зачастую множественные и билатеральные. [10, 11]. Аденокарцинома in situ - чаще “матовое стекло” от 5 до 30 мм [12, 13]. Минимально инвазивная аденокарцинома - “матовое стекло” или частично-солидный узел, при этом солидный компонент чаще менее 5 мм [12, 14]. Инвазивная аденокарцинома может быть как в виде “матового стекла”, так и солидного и частично солидного узла. Инвазивная муцинозная аденокарцинома представлена различным спектром структур (мультифокальные одно- и двусторонние уплотнения, узлы по типу “матового стекла”, солидной и частично-солидной структуры с бронхогенным распространением) [15, 16].
Цель исследования: оценка возможностей комбинированной методики бронхоскопии с щипцовой и щеточной биопсиями под КТ-контролем в режиме флюороскопии (SmartView Rx) с предварительной КТ-навигацией (КТн+БС+КТф) в диагностике периферических очагов в легких по типу “матового стекла” до 3 см в максимальном измерении для повышения результативности и сокращения сроков установки диагноза рака легкого I стадии.
Окончательный диагноз в ряде случаев при очагах по типу “матового стекла” возможно установить только на основании изучения биопсийного материала, получение которого возможно при бронхоскопии - первого метода малоинвазивной диагностики, результативность которого резко возрастает при комбинированном применении с различными навигационными методиками.Материал и методы
В ходе проспективного исследования за период 2024-2025 гг. изучены данные результативности бронхобиопсии под КТ-контролем в режиме флюороскопии с предварительной КТ-навигацией 32 пациентов с очагами в легких по типу “матового стекла” до 3 см в максимальном измерении, у которых не представляется возможным исключить злокачественный характер изменений. Для сравнения проведен ретроспективный анализ результативности бронхоскопии без применения навигационных методов у 38 пациентов за период 20152018 гг. с аналогичными изменениями в легких. Всем пациентам из исследуемой группы при планировании бронхоскопии была выполнена КТн по описанной ранее методике для определения топики очага, идентификации “приводящего” бронха, выделения оптимального маршрута до зоны интереса. Бронхоскопия под КТ-контролем (SmartView Rx) проводилась на 128-срезовом компьютерном томографе фирмы “General Electric” “Optima CT 660” с флюороскопической установкой. Проводились цитологические, иммуноцитохимические, в ряде случаев гистологические и иммуногистохимические исследования. Проведен статистический анализ, во всех случаях результат считался статистически значимым (р < 0,05).
Результаты исследования
Сложность выполнения диагностически значимой бронхоскопии заключается в отсутствии визуализации бронхов дистальнее 4-5-го уровня
деления бронхиального дерева. Результативность процедуры зависит от ряда факторов, таких как размеры, топика, взаимосвязь очага с бронхом. Задача дополнительно усложняется в случаях, когда материал необходимо получить из очага по типу “матового стекла”. Так как патоморфологически эти изменения характеризуются низкой клеточной плотностью, если они обусловлены злокачественным поражением, зачастую дают ложноотрицательные результаты при стандартной биопсии - опухоль имеет стелящийся рост вдоль стенок альвеол и бронхов, степень нарушения архитектоники которых, зависит от стадии заболевания. Данные вопросы мы попытались решить за счет тройной комбинации лучевых и эндоскопических методов.
На первом этапе пациентам из обеих групп проведена КТн с целью определения визуализации “приводящего” бронха (рис. 1).
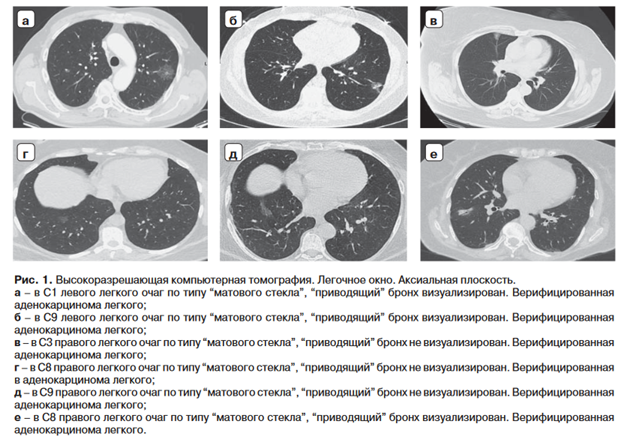
При наличии визуализации “приводящего” бронха определен тип взаимосвязи согласно классификации E. Tsuboi 1967 г. (рис. 2) [17].

У 21 (65,6%) из 32 пациентов из основной группы визуализировался “приводящий” к очагу бронх. Не визуализирован у 11 (34,3%). У 21 (55,2%) из 38 пациентов контрольной группы визуализировался “приводящий” к очагу бронх. Не визуализирован у 17 (44,7%) (табл. 1).

На втором этапе пациентам из исследуемой группы на основании полученных ранее данных выполнена бронхоскопия с различными вариантами бронхобиопсий (щипцовая и щеточная) из очагов по типу “матового стекла” под КТ- контролем в режиме флюороскопии. При контрольном сканировании наиболее удобным для просмотра в режиме реального сканирования представлялся легочный режим, позволяющий визуализировать как очаги, так и положение бронхоскопических инструментов относительно последних. С целью повышения результативности бронхобиопсии в 6 сложных клинических ситуациях врач-патоморфолог присутствовал при исследовании для проведения срочного цитологического исследования. В случае отсутствия диагностически значимого материала биопсия проводилась повторно (кратность манипуляции не превышала трех раз). Проведенный сравнительный анализ выявил статистически значимое превосходство комбинированного метода (бронхоскопия с КТ-нави- гацией и интраоперационной КТ-флюороскопией) над традиционным подходом в диагностике очагов по типу “матового стекла” (р < 0,05).
Результативность процедуры для основной группы составила 62,5% против 21,1% в контрольной группе (p = 0,006), прирост +41,4% (табл. 2). Осложнений в ходе исследования выявлено не было.
Подавляющее большинство очагов (65%) в исследуемой группе оказалось по данным цитологического исследования злокачественного характера. Из них 92,1% различные гистологические подтипы аденокарциномы. В обеих группах преобладает инвазивная аденокарцинома - 6 (50%) случаев в исследуемой группе и 3 (75%) - в контрольной группе.
Доброкачественные изменения в исследуемой группе составили 35%, среди них 6 случаев воспалительных/поствоспалительных изменений и 1 случай узловой лимфоидной гиперплазии. В контрольной группе 6 (75%) злокачественных очагов и 2 (25%) случая очагов доброкачественного характера - воспалительные/поствоспалительные изменения (табл. 3).

Клиническое наблюдение
Пациент А., 57 лет. По месту жительства выполнена КТ органов грудной клетки, по результатам которой в С1+2 левого легкого выявлен очаг по типу “матового стекла”.
Пациент в плане дообследования обратился в РНЦРР При пересмотре КТ-данных в периферической зоне С1+2 левого легкого определяется очаг по типу “матового стекла” с “подходящим” бронхом. Предположен злокачественный характер очага. С целью верификации изменений в легком выполнена бронхоскопия с бронхобипсией очага под КТ-контролем в режиме флюороскопии и предварительной КТ-навигацией. По данным КТн определена трасса до зоны интереса. Получен материал. По данным исследования - клетки аденокарциномы легкого (рис. 3).
Обсуждение
Мультимодальный подход к проблеме диагностики очагов в легких по типу “матового стекла” с применением современных методов позволяет установить диагноз в более сжатые сроки. Материал, полученный при биопсии легкого, должен быть репрезентативным, позволяющим выполнить полноценное морфологическое исследование. В случае злокачественного характера изменений установление диагноза на ранней стадии позволяет провести радикальное лечение, что повлияет на показатели выживаемости и качество жизни больных.
Заключение
Комбинированный метод бронхоскопии с КТ- навигацией и КТ-флюороскопией продемонстрировал высокую эффективность в диагностике периферических очагов в легких по типу “матового стекла” при минимальной инвазивности процедуры. Комбинированный метод может рассматриваться как метод выбора для верификации периферических очаговых образований в легких по типу “матового стекла”.
Список литературы
Agrawal S., Goel A.D., Gupta N., Lohiya A. Role of low dose computed tomography on lung cancer detection and mortality - an updated systematic review and metaanalysis. MonaldiArch. Chest. Dis. 2022; 93 (1).
Chen C., Ou X., Li H. et al. Contrast-Enhanced CT Texture Analysis: a New Set of Predictive Factors for Small Cell Lung Cancer. Mol. Imaging Biol. 2020; 22 (3): 745-751.
Ye X., Chen S., Tian Y. et al. A preliminary exploration of the intravoxel incoherent motion applied in the preoperative evaluation of mediastinal lymph node metastasis of lung cancer. J. Thorac. Dis. 2017; 9 (4): 1073-1080.
Гомболевский В.А., Блохин И.А., Лайпан А.Ш. и др. Методические рекомендации по скринингу рака легкого. Серия “Лучшие практики лучевой и инструментальной диагностики”. ГБУЗ “НПКЦ ДиТ ДЗМ”. 2020; 56: 60. ISSN 2618-7124.
Петросян А.П., Силантьева Н.К., Шавладзе З.Н., Березовская Т П., Агабабян Т.А. Использование терминов “очаг” и “образование” в протоколах описания компьютерно-томографических исследований легких (обзор литературы). Радиология-практика. 2018; 2: 56-66.
Petrosian A.P., Silant’eva N.K., Shavladze Z.N. et al. The Use of the Terms “Nodule” and “Mass” in Describing Lung Computed Tomography (Literature Review). Radiology- Practice. 2018; 2: 56-66. (In Russian)
Farjah F, Monsell S.E., Smith-Bindman R. et al. Fleischner Society Guideline Recommendations for Incidentally Detected Pulmonary Nodules and the Probability of Lung Cancer. J. Am. Coll. Radiol. 2022; 19 (11): 1226-1235.
Martin M.D., Kanne J.P., Broderick L.S. et al. RadioGraphics Update: Lung-RADS 2022. Radiographics. 2023; 43 (11): e230037.
Zhu Y., Yang L., Li Q. et al. Factors associated with concurrent malignancy risk among patients with incidental solitary pulmonary nodule: A systematic review taskforce for developing rapid recommendations. J. Evid. Based. Med. 2022; 15 (2): 106-122.
Mazzone P.J., Lam L. Evaluating the Patient With a Pulmonary Nodule: A Review. JAMA. 2022; 327 (3): 264-273
Nguyen C., Larsen N.K., Dietz N. et al. Pulmonary Atypical Adenomatous Hyperplasia: Diagnostic and Therapeutic Implications. Cureus. 2019; 11 (11): e6079.
Kakinuma R., Ohmatsu H., Kaneko M. et al. Progression of focal pure ground-glass opacity detected by low-dose helical computed tomography screening for lung cancer. J. Comput. Assist. Tomogr. 2004; 28 (1): 17-23.
Cohen J.G., Reymond E., Lederlin M. et al. Differentiating pre- and minimally invasive from invasive adenocarcinoma using CT-features in persistent pulmonary part-solid nodules in Caucasian patients. Eur. J. Radiol. 2015; 84 (4): 738-744
Cao L., Wang Z., Gong T. et al. Discriminating between bronchiolar adenoma, adenocarcinoma in situ and minimally invasive adenocarcinoma of the lung with CT. Diagn. Interv. Imaging. 2020; 101 (12): 831-837.
Mirka H., Ferda J., Krakorova G. et al. The Use of CT Pattern in Differentiating Non-invasive, Minimally Invasive and Invasive Variants of Lung Adenocarcinoma. Anticancer Res. 2021; 41 (9): 4479-4482.
Sun Y.L., Gao F., Gao P. et al. Diagnostic value of contrast- enhanced CT scans in identifying lung adenocarcinomas manifesting as ground glass nodules. Chinese J. Oncol. 2018. 40 (7): 534-538.
Ban X., Shen X., Hu H. et al. Predictive CT features for the diagnosis of primary pulmonary mucoepidermoid carcinoma: comparison with squamous cell carcinomas and adenocarcinomas. Cancer Imaging. 2021; 21 (1): 2.
Tsuboi E., Ikeda S., Tajima M. et al. Transbronchial biopsy smear for diagnostic of peripheral pulmonary carcinomas. Cancer. 1967; 20 (5): 687-698.
Автор:
Лагкуева Ирина Джабраиловна - канд. мед. наук, заведующая отделением рентгеновской диагностики с кабинетами рентгеновской и магнитно-резонансной компьютерной томографии ФГБУ “Российский научный центр рентгенорадиологии” Минздрава России, Москва.
Черниченко Наталья Васильевна - доктор мед. наук, ведущий научный сотрудник научно-исследовательского отдела хирургии и хирургических технологий в онкологии ФГБУ “Российский научный центр рентгенорадиологии” Минздрава России, Москва.
Нуднов Николай Васильевич - доктор мед. наук, профессор, заместитель директора по научной работе ФГБУ “Российский научный центр рентгенорадиологии” Минздрава России, Москва.
Мурзин Ярослав Юрьевич - доктор мед. наук, врач торакальный хирург отделения хирургических методов лечения и противоопухолевой лекарственной терапии опухолей головы и шеи с койками торакальной онкологии хирургии и сосудистой хирургии ФГБУ “Российский научный центр рентгенорадиологии” Минздрава России, Москва.
Мельникова Надежда Васильевна - канд. мед. наук, заведующая цитологической лабораторией патологоанатомического отделения ФГБУ “Российский научный центр рентгенорадиологии” Минздрава России, Москва.
Солодкий Владимир Алексеевич - академик РАН, профессор, доктор мед. наук, директор ФГБУ “Российский научный центр рентгенорадиологии” Минздрава России, Москва.
Теги: очаги в легких по типу “матового стекла”
234567 Начало активности (дата): 02.12.2025
234567 Кем создан (ID): 989
234567 Ключевые слова: бронхоскопия с бронхобиопсией; КТ-навигация; КТ-флюороскопия; очаги в легких по типу “матового стекла”; рак легкого
12354567899
Похожие статьи
Интерстициальные заболевания легких в клинической практикеРентген на дому 8 495 22 555 6 8
Трудности диагностики метастатического поражения легких
Клинико-рентгено-морфологическая диагностика гиперчувствительного пневмонита
Внебольничная пневмония у взрослых



