 04.06.2024
04.06.2024
Сравнительный анализ методов полностью эндоскопической декомпрессии плечевого сплетения и мини-инвазивной техники с эндоскопической ассистенцией в лечении пациентов с травматической брахиоплексопатией
Брахиоплексопатия является актуальным полиэтиологичным заболеванием со встречаемостью
ВВЕДЕНИЕ
Брахиоплексопатиями (БПП) называют группу состояний различной этиологии, сопровождающихся поражением плечевого сплетения на любом его уровне, что приводит к нарушению функции верхней конечности вследствие развития двигательных, чувствительных и вегетативных расстройств. Согласно последним исследованиям, частота развития БПП, по данным разных авторов, варьирует от 0,17 до 1,6 на 100 тыс. населения в год [1-7].
Этиология включает в себя как травмы, открытые и закрытые, так и нетравматические причины (врожденные аномалии развития, постлучевой плексит и идиопатические БПП).
Общепринято считать, что при развитии симптомов БПП следует проводить нейровизуализацию с целью установления наличия или отсутствия нарушения анатомической целостности нервных структур. При наличии анатомического перерыва нерва, его спонтанное восстановление считается невозможным, что требует безотлагательного оперативного лечения с применением пластики либо невротизации поврежденных нервов [8-10]. В случае же отсутствия достоверных данных за нарушение анатомической целостности нервов, считается, что возможно восстановление проводимости по нервам на фоне консервативного лечения в течение 3-6 месяцев, и, если в течение данного промежутка времени восстановления не происходит, проведение оперативного лечения [11-13].
Одним из вариантов оперативного лечения в подобных случаях является невролиз, суть которого заключается в освобождении нервов от рубцов и спаек, и который можно проводить с использованием малотравматичной эндоскопической техники. В течение последних двух десятилетий произошло развитие данной операции, и сформировались два основных подхода для её проведения:
невролиз плечевого сплетения под видеоэндоскопической ассистенцией [14-16];
полностью эндоскопический невролиз плечевого сплетения, в том числе робот-ассистированный [17-20].
Единичные опубликованные работы доказывают эффективность обоих методов, однако их сравнение ранее не проводили, что обусловливает актуальность данной работы.
Цель работы — сравнить два основных существующих на данный момент метода проведения невролиза плечевого сплетения с использованием эндоскопа.
МАТЕРИАЛЫ И МЕТОДЫ
В наше исследование включено 22 пациента (18 мужчин, 4 женщины) с установленным на основании жалоб, анамнеза, данных осмотра и инструментальных методов исследований диагнозом «посттравматическая брахиоплексопатия». Пациенты прооперированы на базах отделения травматологии и ортопедии ГКБ им. Буянова (Москва) и отделения нейрохирургии № 5 Федерального центра нейрохирургии (Тюмень) с 2015 по 2022 гг.
Исследование носило ретроспективный характер.
Критерии включения пациентов в исследование:
установленный на основании жалоб, анамнеза, данных инструментальных исследований диагноз «посттравматическая брахиоплексопатия»;
отсутствие по данным исследований достоверных признаков нарушения анатомической целостности структур плечевого сплетения;
неполное восстановление функции поражённой конечности на фоне адекватного консервативного лечения в течение 6 мес. и более до момента госпитализации;
значительное нарушение функции верхней конечности, снижающее качество жизни пациента;
возраст пациентов 18 лет и старше.
Критерии невключения пациентов в исследование:
нетравматический характер поражения плечевого сплетения;
степень пареза мышц по Британской шкале < 2 баллов;
отказ пациента от участия в исследовании.
В группу 1 включено 8 пациентов, которым по показаниям выполнена артроскопия плечевого сустава и полностью эндоскопическая декомпрессия плечевого сплетения. В группу 2 включено 14 пациентов, которым по показаниям выполнена ревизия, невролиз плечевого сплетения под виеоэндоскопической ассистенцией.
В группе 1 средний возраст пациентов составил 53,3 ± 20,1 года, соотношение полов (мужчины/жен- щины) составило 6/2, сторона поражения (правая/левая) — 6/2. В группе 2 средний возраст пациентов составил 46,8 ± 13 лет, соотношение полов (мужчины/женщины) составило 12/2, сторона поражения (правая/левая) — 3/11.
Всем пациентам при госпитализации проведены исследования согласно общепринятым стандартам. Неврологический осмотр проведен с определением мышечной силы по Британской шкале (BMRC, М5-М0). Использованы следующие шкалы и опросники: опросник неспособностей верхних конечностей (англ. Disabilities of the arm, shoulder and hand, DASH), нумерологическая оценочная шкала боли (НОШ) [21]. Проведены стимуляционная ЭНМГ и МРТ плечевого сплетения с целью исключения нарушения анатомической целостности его структур.
Статистическую обработку данных проводили с использованием пакета программ Microsoft Excel (Microsoft Office 365) и Stattech 2.0. Для количественных признаков рассчитывали среднее арифметическое (М) и стандартную ошибку средней (SEM). Для оценки статистической значимости полученных результатов использовали критерий Шапиро - Уилка, для оценки нормальности распределения признака, в случае ненормального распределения применяли непараметрический U-критерий Манна - Уитни. Различия считали значимыми при p < 0,05. Округление полученных нецелых значений производили с точностью до десятой части.
Хирургическая техника
Оперативное вмешательство у пациентов группы 1
Операцию выполняли в положении пациента «пляжное кресло» под эндотрахеальным наркозом. Первым этапом выполняли лечебно-диагностическую артроскопию плечевого сустава с осмотром внутрисуставных структур и выявлением внутрисуставной патологии. При выявлении признаков хронического теносиновита сухожилия длинной головки бицепса (СДГБ) выполняли его тенотомию. При выявлении дегенеративных изменений фиброзной губы гленоида выполняли дебридмент изменённых участков фиброзной губы.
Участки хондромаляции суставного хряща головки плеча и гленоида обрабатывались шейвером и аблятором. При выявлении дегенеративных изменений сухожилий вращательной манжеты плеча (ВМП) выполняли дебридмент изменённых участков ВМП. При выявлении массивного невосстановимого повреждения сухожилия надостной мышцы устанавливали субакромиальный спейсер (рис. 1).
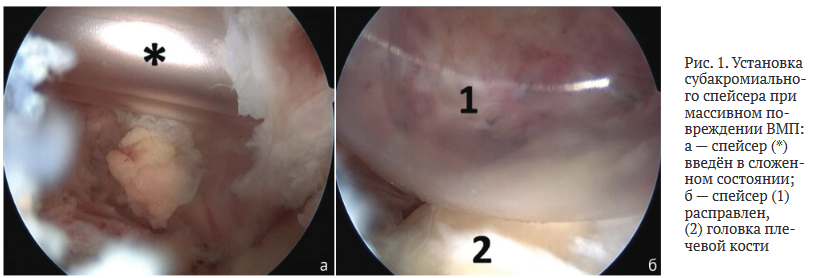
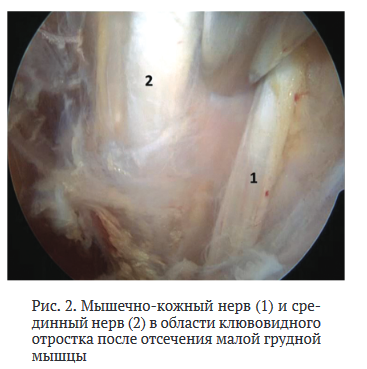
Далее производили иссечение тканей ротаторного интервала, визуализировали клювовидный отросток лопатки, выполняли релиз тканей вокруг клювовидного отростка, определяя клювовидно-акромиальную связку, объединённое сухожилие, малую грудную мышцу. Затем производили отсечение малой грудной мышцы от клювовидного отростка и смещали её кнутри, что являлось компонентом декомпрессии сосудистонервного пучка в области малой грудной мышцы. Через сформированное «окно» осуществляли диссекцию тканей и визуализировали компоненты плечевого сплетения и сосуды. Рассекая рубцово-спаечные ткани в этой области, выполняли невролиз и декомпрессию сосудисто-нервного пучка (рис. 2).
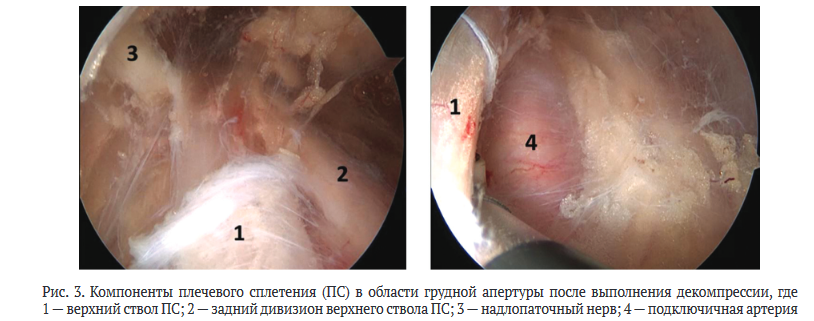
Производили диссекцию тканей у основания клювовидного отростка и кнутри от него. Визуализировали подключичную мышцу и отсекали латеральную порцию мышцы от ключицы, формируя «окно» к грудной апертуре.
Далее выполняли диссекцию тканей в области грудной апертуры, рассекая рубцово-спаечные ткани вокруг сплетения и между его компонентами, визуализировали компоненты ПС и подключичную артерию (рис. 3).
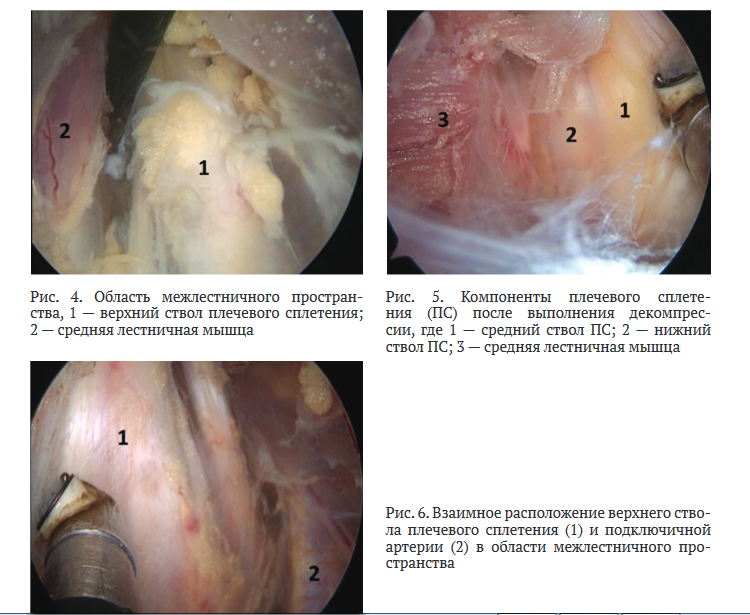
Формировали надключичные порты, куда переводили артроскоп и рабочий инструмент (рис. 7), выполняли диссекцию тканей и осуществляли доступ к межлестничному пространству. Производили рассечение рубцово-спаечных тканей вокруг стволов плечевого сплетения и между ними, осуществляя декомпрессию и невролиз. Визуализировали верхний, средний и нижние стволы ПС, подключичную артерию и среднюю лестничную мышцу (рис. 4, 5, 6).
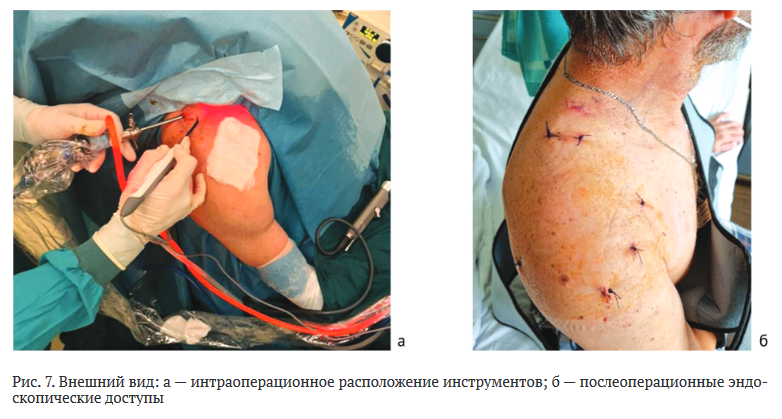
Заключительным этапом операции зашивали послеоперационные раны, накладывали асептические повязки, верхнюю конечность иммобилизировали в косыночном ортезе (рис. 7).
Оперативное вмешательство у пациентов группы 2
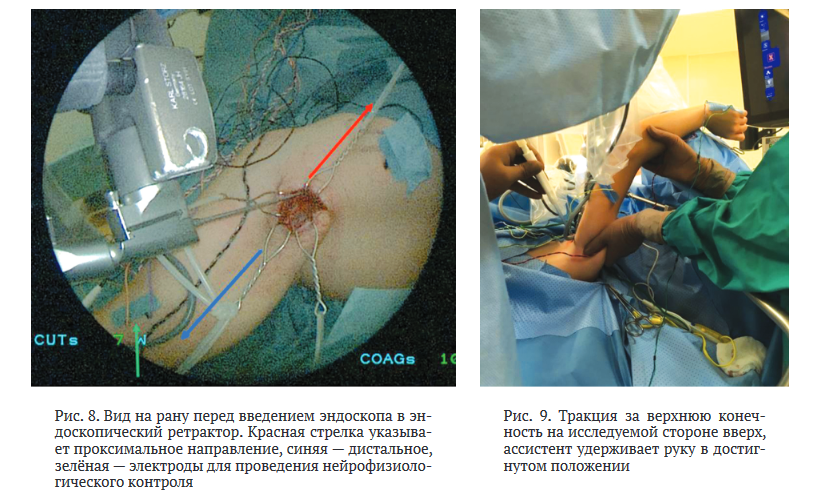
После вскрытия подмышечной фасции выделяли сосудисто-нервный пучок, в нем идентифицировали нервы, артерию и вены, фиксировали их на держалки. После этого в рану параллельно сосудисто-нервному пучку вводили ретрактор с оптикой. Дальнейшие действия производили под контролем эндоскопической оптики и с помощью инструментов для эндоневролиза.
Проводили диссекцию нейро-сосудистых структур в проксимальном направлении до достижения рёберно-ключичного пространства. Затем верхнюю конечность на исследуемой стороне ассистент отводил кпереди от пациента за плечо и удерживал в таком положении (рис. 9), что обеспечивало протракцию ключицы и расширение рёберно-ключичного пространства (рис. 10).
Интерпретация возможных результатов
Результаты лечения оценивали на основании данных шкал и опросников, неврологического осмотра и подтверждали данными функциональной диагностики (стимуляционная ЭНМГ) через 6 мес. после операции. При неврологическом осмотре отдельно оценивали два показателя: сила и боль. Положительным результатом считали увеличение силы в пораженных мышцах на 1 балл и более. Боль оценивали по шкале НОШ, положительным результатом считали уменьшение болевого синдрома на 50 % и более.
РЕЗУЛЬТАТЫ
В группе 1 положительные результаты лечения достигнуты в 87,5 % случаев (n = 7). В одном случае положительный результат не достигнут, ухудшения состояния после операции не наблюдали. В группе 2 положительные результаты лечения достигнуты в 92,9 % случаев (n = 13). В одном случае положительный результат не достигнут, ухудшения состояния после операции не наблюдали. Результаты лечения пациентов представлены в таблице 1.
В связи со значительными отличиями в методах проведения операции сравнение проводили по универсальной шкале DASH. Для этого высчитывали разницу в показателе до и после операции в каждой группе, затем высчитывали среднее арифметическое и стандартную ошибку среднего по полученным данным. В группе 1 значение (М ± SEM) составило 23,5 ± 3,6, в группе 2 — 19,4 ± 5,4, при р > 0,05.
По данным стимуляционной ЭНМГ у пациентов отмечали сокращение латентного периода и увеличение амплитуды М-ответа (рис. 12, 13).
ОБСУЖДЕНИЕ
С момента внедрения миниинвазивных методов в хирургию периферических нервов с 60-х годов прошлого столетия произошло становление современных принципов хирургии периферических нервов и плечевого сплетения в частности. С тех пор основными направлениями в данной области считаются:
проведение невротизации проксимальных отделов плечевого сплетения проходящими вблизи них нервами, такими как добавочный, диафрагмальный, межреберные и др.;
проведение невротизации конечных и коротких ветвей плечевого сплетения расположенными рядом функционирующими нервами, например, невротизация срединного нерва лучевым нервом, невротизация мышечно-кожного
нерва локтевым нервом и т.д.;
транспозиция мышц.
Роль невролиза плечевого сплетения как самодостаточного метода хирургического лечения долгое время не воспринимали всерьез, рассматривали, скорее, как этап проведения операции по пластике или невротизации нервов, позволяющий провести анализ повреждения, окончательно установить степень повреждения нервных структур и определить их уровень [22].
В 1973 г. вышел обзор литературы, в котором приведены сведения об эффективности невролиза плечевого сплетения и утверждения, что невролиз является эффективным методом лечения при локальных фиброзных поражениях, но не считается панацеей [23].
Включение эндоскопической техники в арсенал методик хирургического лечения периферических нейропатий началось относительно недавно, в 80-х годах XX века, когда впервые под контролем артроскопа было предложено проводить декомпрессию срединного нерва на уровне запястного канала [24]. Применение эндоскопа в хирургии непосредственно плечевого сплетения было предложено позже, в 90-х годах, когда в эксперименте впервые была проведена ревизия корешков плечевого сплетения под эндоскопической ассистенцией [14]. Позже K.G. Krishnan et al., проведя исследования на трупах, одними из первых предложили проводить ревизию плечевого сплетения как диагностическую операцию, направленную на выявление степени повреждения плечевого сплетения и планирования дальнейшей тактики лечения, помимо этого, обозначив основные анатомические ориентиры при его выполнении через над- и подключичный доступы [14]. Аналогичное исследование, но с использованием роботизированной техники, проведено G. Mantovani et al. на двух плечевых сплетениях на одном свежем кадавере [17].
Первый, встречающийся в литературе случай проведения эндоскопической ревизии плечевого сплетения на живом человеке, описан в 2006 г., когда пациенту с закрытой травмой плечевого сплетения вследствие ДТП была проведена данная операция, через 6 мес. после которой наступило полное восстановление силы и чувствительности в пораженной руке [15]. Проводимую с 1910 г. резекцию первого ребра при синдроме верхней апертуры впервые было предложено проводить под видеоэндоскопической ассистенцией в 2007 г. [26]. В 2017 г. T. Lafosse et al. предложили оригинальный метод проведения невролиза всех отделов плечевого сплетения при синдроме верхнего грудного выхода [18]. Чуть позже, в 2020 г., той же группой ученых доказана эффективность данного метода при лечении взрослых с брахиоплексопатиями, возникшими вследствие вывиха плечевого сустава, и предложен алгоритм ведения пациентов с данной патологией [19]. В 2021 г. группой учёных предложен метод эндоскопической ревизии и невролиза плечевого сплетения, позволяющий при необходимости проводить вмешательства на плечевом суставе, что является актуальным для пациентов с сочетанной патологией [20]. В 2023 г. опубликованы положительные результаты лечения пациентов с брахиоплексопатиями различной этиологии методом невролиза под видеоэндоскопической ассистенцией, позволяющим проводить операцию через один трансаксиллярный доступ, особенно при использовании способа расширения рёберно-ключичного пространства [16, 27].
Несмотря на развитие эндоскопического направления в лечении пациентов с брахиоплексопатиями, широкое его применение ограничено до сих пор. В последнем, наиболее полном, руководстве по ведению и хирургическому лечению пациентов с брахиоплексопатиями от 2021 г. невролиз плечевого сплетения указыван лишь в историческом аспекте, а его применение с использованием эндоскопа не описано вовсе [21].
На основании опубликованных исследований на данный момент возможно разделение методов эндоскопического невролиза плечевого сплетения на несколько типов:
невролиз плечевого сплетения под видеоэндоскопической ассистенцией;
полностью эндоскопический невролиз плечевого сплетения, в том числе робот-ассистированный.
В связи с появлением разных вариантов проведения операций невролиза плечевого сплетения с использованием эндоскопа и положительными результатами можно сделать заключение об отсутствии оптимального общепризнанного метода лечения и об активном развитии данного направления хирургии.
В целом, исходя из проведенного исследования, следует, что невролиз с использованием эндоскопа является малотравматичным методом лечения посттравматических брахиоплексопатий у пациентов с неглубоким парезом в пораженных группах мышц при неэффективности консервативного лечения. В данном исследовании результаты лечения пациентов группы 1, в которой помимо невролиза плечевого сплетения проводили восстановление плечевого сустава, статистически не отличались от результатов пациентов группы 2, где проводили только невролиз плечевого сплетения. Это означает, что при изолированном поражении плечевого сплетения обе методики являются эффективными и имеют примерно схожие и ожидаемые исходы лечения, в случае же сочетания плексопатии с патологией плечевого сустава приемлемо одномоментное комбинированное вмешательство с коррекцией внутрисуставной патологии и невролизом, что способствует более полному и раннему восстановлению функции верхней конечности.
Коллектив авторов предполагает, что требуется дальнейшее изучение темы с целью создания оптимального лечебно-диагностического алгоритма для пациентов с брахиоплексопатиями.
ЗАКЛЮЧЕНИЕ
Техники проведения невролиза плечевого сплетения с использованием эндоскопа эффективны при лечении посттравматических брахиоплексопатий у взрослых в случае наличия силы в пораженных мышцах в 2 балла и более по Британской шкале. В данном исследовании метод проведения эндоскопического невролиза плечевого сплетения в сочетании с артроскопией плечевого сустава в равной степени эффективен в сравнении с изолированным мини-инвазивным невролизом плечевого сплетения под видеоэндоскопической ассистенцией. Лечение пациентов с посттравматической брахиоплексопа- тией является трудной задачей и требует мультидисциплинарного подхода.
СПИСОК ИСТОЧНИКОВ
Kaiser R, Waldauf P, Ullas G, Krajcova A. Epidemiology, etiology, and types of severe adult brachial plexus injuries requiring surgical repair: systematic review and meta-analysis. Neurosurg Rev. 2020;43(2):443-452.
Tapp M, Wenzinger E, Tarabishy S, Ricci J, Herrera FA. The Epidemiology of Upper Extremity Nerve Injuries and Associated Cost in the US Emergency Departments. Ann Plast Surg. 2019;83(6):676-680. doi: 10.1097/SAP.0000000000002083
Narakas AO. The treatment of brachial plexus injuries. IntOrthop. 1985;9(1):29-36. doi: 10.1007/BF00267034
Kaiser R, Waldauf P, Haninec P. Types and severity of operated supraclavicular brachial plexus injuries caused by traffic accidents. Acta Neurochir (Wien). 2012;154(7):1293-1297. doi: 10.1007/s00701-012-1291-7
MacDonald BK, Cockerell OC, Sander JW, Shorvon SD. The incidence and lifetime prevalence of neurological disorders in a prospective community-based study in the UK. Brain. 2000;123(Pt 4):665-676. doi: 10.1093/brain/123.4.665
Rasulic L, Simic V, Savic A, et al. Management of brachial plexus missile injuries. Acta Clin Croat. 2018;57(3):487-496. doi: 10.20471/acc.2018.57.03.12
Flores LP. Estudo epidemiologico das lesoes traumaticas de plexo braquial em adultos [Epidemiological study of the traumatic brachial plexus injuries in adults]. Arq Neuropsiquiatr. 2006;64(1):88-94. (In Portuguese) doi: 10.1590/ s0004-282x2006000100018
Midha R. Nerve transfers for severe brachial plexus injuries: a review. Neurosurg Focus. 2004;16(5):E5. doi: 10.3171/ foc.2004.16.5.6
Siqueira MG, Malessy MJA. Traumatic brachial plexus lesions: clinical and surgical aspects. In: Treatment of peripheral nerve lesions. Prism Books; 2011:93-110.
Terzis JK, Papakonstantinou KC. The surgical treatment of brachial plexus injuries in adults. Plast Reconstr Surg. 2000;106(5):1097-1122; quiz 1123-4. doi: 10.1097/00006534-200010000-00022
Bertelli jA, Ghizoni MF. Results and current approach for Brachial Plexus reconstruction. J Brachial Plex Peripher NerveInj. 2011;6(1):2. doi: 10.1186/1749-7221-6-2
Millesi H. Update on the treatment of adult brachial plexus injuries. In: Brachial plexus injuries. Martin Dunitz Ltd.; 2001:77-90.
Siquiera MG, Martins R, Heisse O, Socolovsky M (2010) Lesiones traumaticas del plexobraquial e adultos: Parte 1. Mecanismos de lesion, metodosdiagnosticos e indicaciones del tratamientoquirurgico. In: Neurocirug^a,
AspectosClinicosyQuirurgicos, 1st Ed. Corpus, 2010: Ch. 95.
Krishnan KG, Pinzer T, Reber F, Schackert G. Endoscopic exploration of the brachial plexus: technique and topographic anatomy--a study in fresh human cadavers. Neurosurgery. 2004;54(2):401-408; discussion 408-409. doi: 10.1227/01. neu.0000103423.08860.a9
Braga-Silva J, Gehlen D, Kuyven CR. Endoscopic exploration of a brachial plexus injury. J Reconstr Microsurg. 2006;22(7):539-541. doi: 10.1055/s-2006-951320
Сагдиев Р.Х., Дыдыкин С.С., Шапкин А.Г. и др. Эффективность невролиза плечевого сплетения под видеоэндоскопической ассистенцией при лечении брахиоплексопатий у взрослых. Гений ортопедии. 2023;29(1):7-11. doi: 10.18019/1028-4427-2023-29-1-7-11. EDN: AGNBKO.
Mantovani G, Liverneaux P, Garcia JC Jr, et al. Endoscopic exploration and repair of brachial plexus with telerobotic manipulation: a cadaver trial. J Neurosurg. 2011;115(3):659-664. doi: 10.3171/2011.3.JNS10931
Lafosse T, Le Hanneur M, Lafosse L. All-Endoscopic Brachial Plexus Complete Neurolysis for Idiopathic Neurogenic Thoracic Outlet Syndrome: A Prospective Case Series. Arthroscopy. 2017;33(8):1449-1457. doi: 10.1016/j.arthro.2017.01.050
Le Hanneur M, Colas M, Serane-Fresnel J, et al. Endoscopic brachial plexus neurolysis in the management of infraclavicular nerve injuries due to glenohumeral dislocation. Injury. 2020;51(11):2592-2600. doi: 10.1016/j. injury.2020.08.005
Беляк Е.А., Лазко Ф.Л., Призов А.П. и др. Эндоскопический невролиз плечевого сплетения у пациента с повреждением вращательной манжеты плеча и посттравматической плексопатией (случай из практики). Georgian Med News.
2021;(316-317):30-35.
Shin, A.Y., Pulos, N. (eds) Operative Brachial Plexus Surgery. Springer, Cham.; 2021:639. doi: 10.1007/978-3-030-69517-0
Шевелев И.Н. Травматические поражения плечевого сплетения (клиника, диагностика, микрохирургия). М.; 2005:52-55.
Lusskin R, Campbell JB, Thompson WA. Post-traumatic lesions of the brachial plexus: treatment by transclavicular exploration and neurolysis or autograft reconstruction. JBone Joint Surg Am. 1973;55(6):1159-76.
Nagai H. Tunnel-endoscopy. Arthroscopy. 1980;(5):1-4.
Monsivais JJ, Narakas AO, Turkof E, Sun Y. The endoscopic diagnosis and possible treatment of nerve root avulsions in the management of brachial plexus injuries. J Hand Surg Br. 1994;19(5):547-549. doi: 10.1016/0266-7681(94)90111-2
Abdellaoui A, Atwan M, Reid F, Wilson P. Endoscopic assisted transaxillary first rib resection. Interact Cardiovasc Thorac Surg. 2007;6(5):644-646. doi: 10.1510/icvts.2007.151423
Суфианов А.А., Савдиев Р.Х., Беляк Е.А., Лазко Ф.Л., Суфианов Р.А. Способ расширения рёберно-ключичного пространства при эндоскопической ревизии плечевого сплетения. Патент РФ на изобретение № 2794823С1. 25.04.2023. Бюл. № 12.
Информация об авторах:
Евгений Александрович Беляк — кандидат медицинских наук, доцент кафедры
Ранель Хамитович Савдиев — аспирант
Фёдор Леонидович Лазко — доктор медицинских наук, профессор кафедры
Альберт Акрамович Суфианов — доктор медицинских наук, член-корреспондент РАН, директор
Дмитрий Львович Пасхин — врач нейрохирург
Алексей Петрович Призов — кандидат медицинских наук, доцент
Максим Фёдорович Лазко — кандидат медицинских наук, ассистент кафедры
Николай Васильевич Загородний — доктор медицинских наук, член-корреспондент РАН, заведующий кафедрой
Вклад авторов:
Беляк Е.А., Пасхин Д.Л., Сагдиев Р.Х. — лечение пациентов, проведение операций;
Беляк Е.А., Сагдиев Р.Х., Призов А.П. — сбор и анализ инструментальных исследований;
Беляк Е.А., Лазко Ф.Л., Суфианов А.А., Загородний Н.В., Сагдиев Р.Х. — обработка и обсуждение результатов исследования, написание текста статьи;
Беляк Е.А., Сагдиев Р.Х., Лазко М.Ф. — поисково-аналитическая работа, обсуждение результатов исследования, написание текста статьи.
Теги: плечевой сустав
234567 Начало активности (дата): 04.06.2024 21:04:00
234567 Кем создан (ID): 989
234567 Ключевые слова: брахиоплексопатия, декомпрессия, невролиз, эндоскопия, артроскопия, плечевой сустав, синдром грудной апертуры
12354567899
Похожие статьи
Способ лечения пациентов с массивными разрывами вращательной манжеты плеча:клинический случайРеабилитация больных с заболеваниями и травмой шейного отдела позвоночника в раннем и позднем послеоперационном периоде анализ российских и зарубежных рекомендаций)
Рентген на дому 8 495 22 555 6 8
Отдалённые результаты профилактики лечения перипротезной инфекции в онкоортопедии
Шкалы оценки морфометрической готовности культи конечности к протезированию и технического состояния эксплуатируемого протеза



