 09.06.2025
09.06.2025
Особенности КТ- и МРТ-семиотики фосфатурической мезенхимальной опухоли
Фосфатурическая мезенхимальная опухоль может встречаться в костях и мягких тканях. КТ и МРТ позволяют их выявить и определить границы хирургической резекции, однако должны использоваться как методы второй линии диагностики после радиоизотопных методов. Использование нового диагностического признака
Введение
Остеомаляция - это системное заболевание костной ткани, при котором из-за дефицита кальция и (или) фосфора накапливается неминерализованный остеоид. Это приводит к повышенной мягкости костей и их склонности к переломам.
Этиология данного заболевания разнообразна. Одной из причин является фосфатурическая мезенхимальная опухоль (ФМО), секретирующая фактор роста фибробластов 23 (ФРФ23). В большинстве случаев образования доброкачественные. Однако описаны злокачественные случаи [1, 2]. Кроме того, известны случаи, когда метастазы злокачественных немезенхимальных опухолей начинали секретировать ФРФ23 [3]. Гистологические признаки данной опухоли включают в себя мелкоклеточный гемангиоперицитарный компонент, толстостенные сосуды, грубодисперсные кальци- наты, пролиферацию гигантских клеток, литические очаги остеомаляции и аморфный бесклеточный матрикс [4]. Чаще всего болеют люди среднего возраста, одинаково мужчины и женщины. В России опубликована работа, в которой проанализированы клинические и биохимические характеристики 40 пациентов, а также единичные клинические наблюдения [5-7]. Согласно проведенным исследованиям, в 35% случаев опухоль была локализована в мягких тканях и в 65% в костной ткани [8]. Опухоли могут встречаться в любых мягких тканях и костях, но редко в паренхиматозных органах и ретроперитонеальном пространстве [9-11]. В мягких тканях опухоль чаще всего поражает конечности и их дистальные отделы, тогда как опухоли костей обычно поражают добавочный скелет (ключицы, лопатки, кости верхних конечностей, кости таза и кости нижних конечностей), кости черепа и околоносовые пазухи. Размеры опухолей небольшие и составляют 1-2 см [12]. Поиск опухолей, продуцирующих ФРФ23, строится поэтапно и включает в себя функциональную и анатомическую визуализацию. Для функциональной визуализации применяют методы, основанные на сродстве диагностических радиофармпрепаратов (РФП) к опухолевым рецепторам (соматостатиновые 2А типа SSTR2A): сцинтиграфия с РФП (99тТс-тектротид, 1111п-октреотид) либо позитронно-эмиссионная томография (ПЭТ, ПЭТ/КТ) с РФП (соли галлия: 68Ga DOTA-TATE/DOTA-TOC/DOTA-NOC).
Для анатомической визуализации в зависимости от расположения и природы опухоли применяют МРТ, МСКТ, УЗИ. Однако не всегда есть возможность произвести дорогостоящие и труднодоступные методы функциональной визуализации, поэтому особое значение приобретают более доступные методы исследования - КТ и МРТ В литературе лучевая диагностика данных образований описана в небольшим количестве статей и в большинстве случаев представлена клиническими наблюдениями (всего около 2000) [13, 14]. Это обусловлено редкостью данного заболевания. Кроме того, из-за мал ых размеров и медленного роста опухоль долго остается нераспознанной, а качество жизни пациента стремительно ухудшается. Знание специфики лучевых признаков ФМО позволит повысить выявляемость данных опухолей с помощью КТ и МРТ.
Цель данной работы: проанализировать специфические КТ- и МРТ-признаки ФМО, изучить характерные КТ- и МРТ-признаки ФМО, выявить новые признаки.
Задачи исследования: оценить возможности КТ и МРТ в качестве методов первой линии для топической диагностики ФМО, а также семиотику данных опухолей и выявить новые дифференциально-диагностические признаки.
Дизайн исследования: ретроспективное одно центровое наблюдательное исследование.
Материал и методы
В период с 2019 по 2023 г. в Национальном медицинском исследовательском центре эндокринологии проводилось обследование и лечение 13 пациентов (6 мужчин (46,2%) и 7 (53,8%) женщин в возрасте от 29 до 66 лет (43 ± 15,9 года)) с ФМО костей и мягких тканей. Среди них у 8 (61,5%) пациентов опухоль была расположена в костях, у 5 (38,5%) - в мягких тканях. У всех пациентов выявлена тяжелая гипофосфатемия, проявляющаяся болями в костях, признаками проксимальной миопатии. У пациентов выявили типичные лабораторные маркеры ФРФ23-индуцированной остеомаляции: гипофосфатемия 0,47 [0,42; 0,55] ммоль/л (референсный интервал (РИ) 0,74-1,52), повышение уровня щелочной фосфатазы (ЩФ) до 200 [115; 297] Ед/л (РИ 40-150), сниженный тубулярный индекс реабсорбции фосфора (TRP, %) - 66 [58; 72]% (РИ более 85%).
КТ была выполнена 11 пациентам с ФМО. МСКТ всего тела с болюсным контрастным усилением проводилась на мультидетекторных компьютерных томографах Revolution CT и Optima CT660 и General Electric (GE Healthcare) с параметрами сканирования: коллимация 0,9 мм, интервал реконструкции 0,45 мм, питч 1, скорость вращения трубки 0,75 с.
Внутривенно всем пациентам вводили неионное контрастное средство с помощью двухголовчатого автоматического инъектора со скоростью 4-5 мл/с. Болюс контрастного препарата сопровождался “преследователем” болюса (40-50 мл физиологического раствора). Артериальная и венозная фазы были на 10-й и 34-й секундах после достижения порогового уровня плотности (120-150 ед.Н) в аорте.
МРТ была выполнена 9 пациентам. МРТ костей и мягких тканей конечностей и головы выполняли по стандартному для выбранной области протоколу на магнитно-резонансных томографах Signa Pioneer 3 Тл и Optima MR450w 1,5 Тл General Electric (GE Healthcare) с наличием следующих последовательностей: Т1ВИ, Т2ВИ, Т2 STIR. У 5 пациентов были получены диффузионно-взвешенные изображения. 7 пациентам внутривенно вводили гадолинийсодержащие контрастные средства с помощью двухголовчатого автоматического инъектора со скоростью 4-5 мл/с. Болюс контрастного препарата сопровождался “преследователем” болюса (40-50 мл физиологического раствора).
При этом 7 пациентам были выполнены оба метода диагностики.
Окончательный диагноз был установлен по результатам гистологического исследования у всех пациентов.
У всех пациентов по данным КТ и МРТ оценивали наибольший размер образования и анализировали следующие качественные показатели: локализация, форма (округлая, овальная, неправильная), контуры (ровные, бугристые/дольча- тые), однородность/неоднородность структуры, накопление контрастного препарата, увеличение регионарных лимфатических узлов. При оценке опухолей костей и мягких тканей по данным КТ и МРТ определяли локализацию относительно кости (прилежание к кортикальному слою).
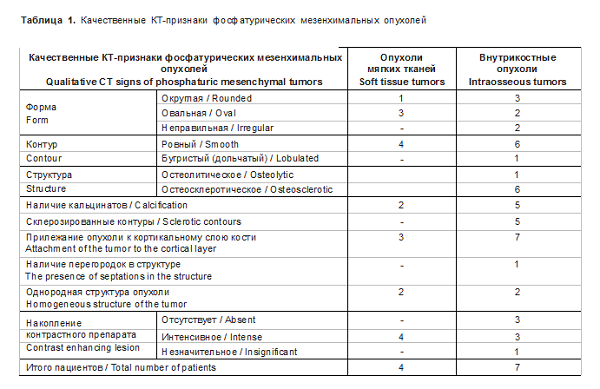
У пациентов с опухолями костей по данным КТ также оценивалось наличие склерозированного контура, кальцинатов, перегородок в структуре.
На полученных МР-изображениях у пациентов с опухолями костей и мягких тканей оценивался МР-сигнал относительно окружающих мышц (ги- пер-, изо-, гипоинтенсивный), наличие ограничения диффузии.
Дополнительно проведен анализ результатов сцинтиграфии c 99|Т|Тс-тектротидом, выполненной 7 пациентам с опухолями костей и 4 пациентам с опухолями мягких тканей (одному пациенту с опухолью кости и одному пациенту с опухолью мягких тканей исследование не проводилось, поскольку ранее им выполнена ПЭТ/КТ с 68Ga DOTA-TATE ).
Статистическая обработка данных была произведена на основе результатов ретроспективного анализа КТ- и МРТ-исследований с помощью электронных таблиц Microsoft Ехсе1, пакета прикладных программ SPSS версии 17.0. Все полученные количественные данные обработаны методом вариационной статистики.
Результаты исследования
В НМИЦ эндокринологии за период с 2019 по 2024 г. было обследовано 13 пациентов (6 мужчин (среди них 4 с опухолями костей, 2 с опухолями мягких тканей) и 7 женщин (среди них 4 с опухолями костей, 3 с опухолями мягких тканей) в возрасте 49 ± 12,8 года (от 29 до 66 лет) (рис. 1).
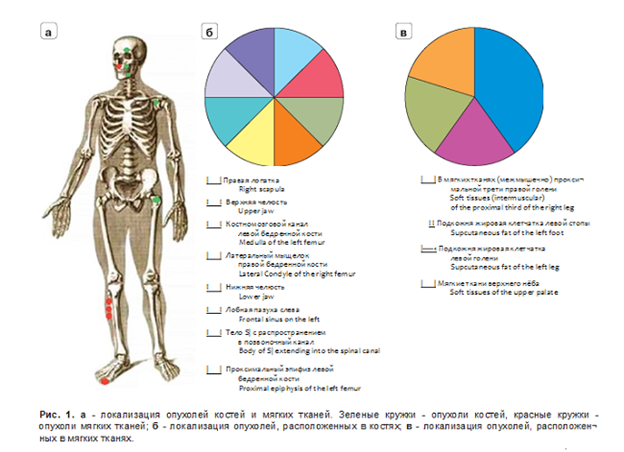
По результатам КТ- и МРТ-исследований выявлено 13 ФМО, среди них 8 (61,5%) пациентов были с опухолями костей и 5 (38,5%) пациентов с опухолями мягких тканей. Зависимость между локализацией и полом пациента не была выявлена.
КТ-исследование было выполнено 7 (63,6%) пациентам с внутрикостными опухолями и 4 (36,4%) пациентам с опухолями мягких тканей, МРТ - 4 (44,4%) пациентам с опухолями мягких тканей и 5 (55,6%) пациентам с опухолями костей. По результатам проведенных КТ- и МРТ-обсле- дований были выявлены различные семиотические признаки.
Опухоли костей были размером в среднем 23 ± 9,6 (от 13 до 41) мм (рис. 2а), опухоли мягких тканей - в среднем 36,2 ± 47,5 (от 12 до 121) мм (рис. 2б). При этом у 4 пациентов размер опухоли был от 12 до 21 мм и в одном случае размер образования был 121 мм.

У пациентов с опухолями мягких тканей преобладала овальная форма (табл. 1). Контуры у всех опухолей были ровные. Опухоли представляли собой небольшие по размеру образования, которые были расположены межмышечно и прилежали к кортикальному слою кости по данным КТ в 75% случаев (субкортикальное расположение).
В 1 наблюдении образование было расположено в подкожной жировой клетчатке голени и не прилежало к кости (рис. 3), в другом наблюдении было расположено в подкожной жировой клетчатке I пальца стопы и прилежало к подошвенной поверхности ногтевой фаланги (рис. 4). По данным МРТ во всех случаях опухоли прилежали к кортикальному слою кости.
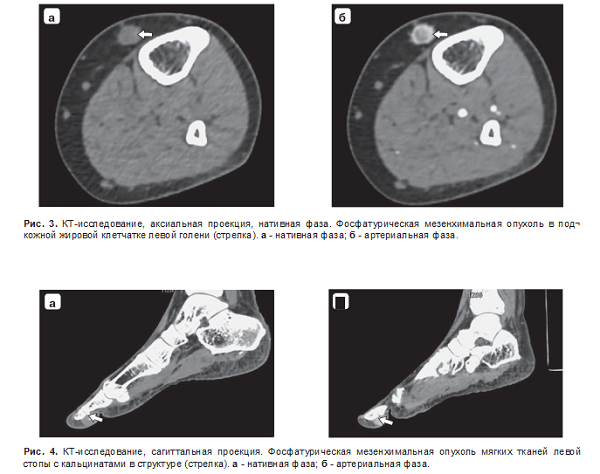
В половине случаев в структуре опухоли определялись обызвествления. Структура опухолей по данным КТ была однородная, в то время как по данным МРТ в половине наблюдений в структуре визуализировались перегородки.
При контрастном усилении при КТ и МРТ опухоли мягких тканей интенсивно накапливали контрастный препарат.
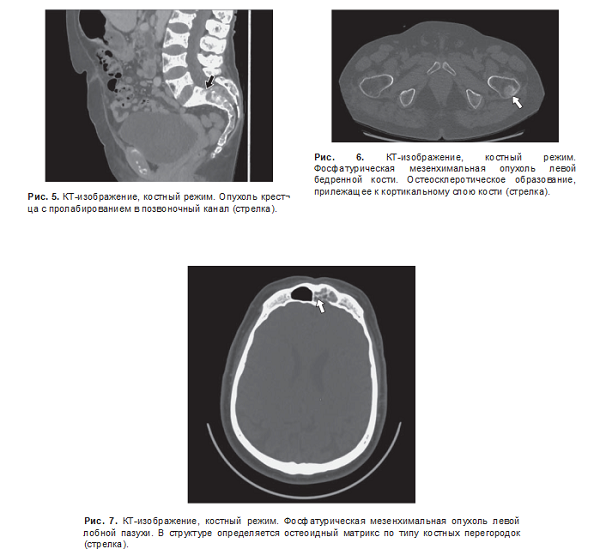
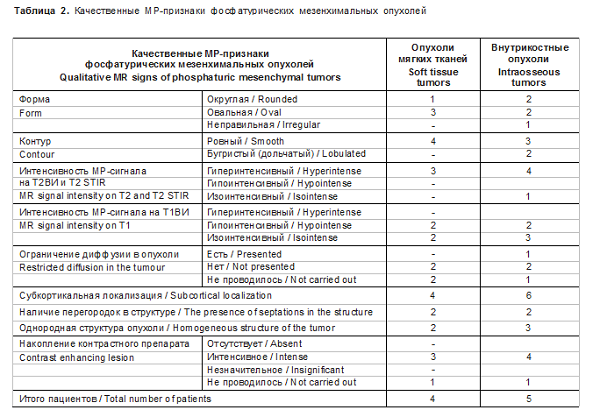
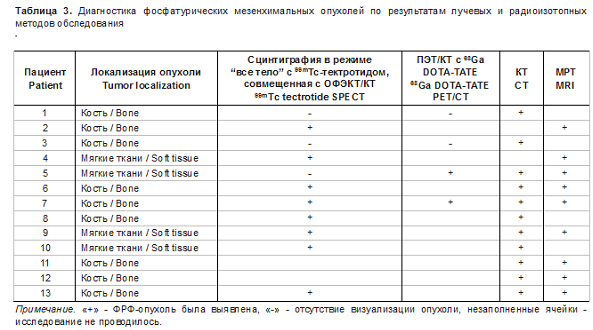
У пациентов с внутрикостным расположением опухоли было небольшое преобладание округлой формы, но встречалась также овальная и неправильная форма. В одном наблюдении была выявлена большая опухоль крестца размером около 40 мм, пролабирующая в позвоночный канал (рис. 5). В большинстве случаев опухоли были остеолитические со склерозированными контурами. Лишь в одном наблюдении образование имело однородную склеротическую структуру (рис. 6). У всех пациентов опухоль была расположена субкортикально. В большинстве случаев структура опухоли была неоднородная за счет остеоидного или хондроидного матрикса, который визуализировался на КТ-изображениях в виде различной формы обызвествлений и кальцина- тов (рис. 7). В 2 (28,6%) наблюдениях в структуре были обызвествления по типу перегородок и в 2 (28,6%) наблюдениях - кальцинаты.
При контрастном усилении опухоли по данным КТ в 3 случаях интенсивно накапливали контрастный препарат, в 3 случаях не накапливали контрастный препарат и лишь в 1 наблюдении отмечалось слабое накопление контрастного препарата. Однако по данным МРТ все образования интенсивно накапливали контрастный препарат (табл. 2).
Опухоли костей и мягких тканей в большинстве наблюдений имели гиперинтенсивный МР-сигнал на Т2ВИ и Т2 STIR ВИ и гипо-/изоинтенсивный МР-сигнал на Т1ВИ. В подавляющем большинстве случаев опухоли не ограничивали диффузию и лишь у одного пациента с внутрикостной локализацией были признаки ограничения диффузии (см. табл. 2).
По результатам сцинтиграфии среди 7 пациентов с опухолями костей отмечались признаки гиперфиксации РФП у 5 (71,4%) пациентов, у 2 (28,6%) пациентов опухоль не была выявлена. Среди 4 пациентов с опухолями мягких тканей у 3 (75%) пациентов была выявлена опухоль, у 1 (25%) пациента опухоль выявить не удалось (табл. 3).
ПЭТ/КТ с 68Ga DOTA-TATE была выполнена 4 пациентам. Из них у 2 пациентов (один с опухолью кости, второй с опухолью мягких тканей) было выявлено патологическое накопление РФП в опухоли.
Обсуждение
Остеомаляция - это системное заболевание костной ткани, когда из-за недостаточного поступления кальция и/или фосфора в кости накапливается неминерализованный остеоид, костная ткань становится крайне хрупкой, развиваются множественные переломы.
Основными причинами являются: 1) недостаток поступления кальция или фосфора в организм (вследствие мальабсорбции, заболеваний желудочно-кишечного тракта, дефицита витамина D и др.), 2) перераспределение минералов в организме (при острых состояниях, декомпенсированном сахарном диабете и др.), 3) избыточное выведение минералов (заболевания почек, наследственные рахиты, прием лекарственных средств, опухоль, секретирующая ФРФ23, гиперпаратире- оз и др.). ФРФ23-продуцирующая опухоль проявляется гипофосфатемией, снижением тубулярной реабсорбции фосфатов, множественными переломами, болями в костях, мышечной слабостью. После удаления опухоли симптомы остеомаляции нивелируются.
Образования обычно небольшого размера, в среднем 3,4 (1,1-9,8) см [15]. Как правило, они расположены либо в костях, либо в мягких тканях, реже в костях с распространением в мягкие ткани. Костная локализация в нашем исследовании выявлялась чаще (у 8 пациентов). Преобладание костной локализации подтверждается данными литературы [16].
На МР-изображениях ФМО обычно изоинтенсивны на Т1, гиперинтенсивны на Т2. Солидный компонент обычно интенсивно накапливает контрастный препарат [17]. По данным A.L. Richardson и соавт., с ростом опухоли увеличивается выраженность неоднородности ее структуры на Т2ВИ и неоднородность контрастирования на МР- изображениях. В структуре можно выявить участки “flow voids” (области с выпадением МР-сигнала из-за эффектов кровотока), представляющие собой попавшие в срез резко расширенные извитые питающие сосуды [18].
С целью топической диагностики данных опухолей используются различные методы диагностики: КТ, МРТ, ПЭТ/КТ с солями галлия: 68Ga DOTA-TATE/68Ga DOTA-NOC, 1111п-пентетреотидом (октрео тидом), соматостатин-рецепторная сцин- тиграфия (с применением 99тТс-тектротида).
Радионуклидные методы диагностики имеют первостепенное значение в выявлении данных образований. В настоящее время ПЭТ/КТ с применением 68Ga-DOTA-TATE, соматостатин-рецепторная сцинтиграфия (с применением 99тТс-тектротида) имеют тропность к соматостатиновым рецепторам подтипа 2, активно используются для выявления нейроэндокринных опухолей и ФРФ23-опухолей и являются наиболее надежными методами локализации данных опухолей. Однако не всегда есть возможность проведения данных методов исследования, что вынуждает осуществлять поиск опухоли с помощью МСКТ- и МРТ-исследований.
По данным КТ внутрикостные ФМО имеют неспецифические признаки. Как правило, это остеолитические, гораздо реже остеосклеротические или смешанные остеолитические и остеосклеротические образования с четкими, преимущественно склерозированными, ровными контурами, которые имеют узкую зону перехода и обычно содержат внутренний матрикс [19]. Данные изменения также были выявлены и в нашем исследовании (см. табл. 1).
Оценка внутреннего матрикса (кальцификации) в структуре опухоли играет важную роль, так как он специфичен для данного типа опухоли [20]. В наших исследованиях он был выявлен у большинства пациентов (у 5 из 7).
Обызвествления могут быть точечные, аморфные по типу тонких костных перегородок и даже по типу “матового стекла”. Этот КТ-признак коррелирует с паттерном кальцификации в опухоли, который напоминает примитивный хрящ или кость, наблюдаемые при гистологическом исследовании [20]. При этом вздутие кости не определялось ни у одного пациента. В 2 наблюдениях отмечалось локальное истончение (эндостальная деструкция) кортикального слоя на уровне внутрикостно расположенного образования.
Сложность поиска опухоли при оценке костей часто обусловлена множественными переломами, сопутствующими остеомаляции, в том числе с формированием избыточных костных мозолей, имитирующих опухолевую ткань.
Данные опухоли следует дифференцировать от бурых опухолей, гигантоклеточных опухолей, остеосаркомы и хондробластомы [17, 21]. Данные опухоли могут напоминать неоссифицирующую фиброму кости, гигантоклеточную опухоль, фиброзную гистиоцитому, фиброзную дисплазию, хрящевые опухоли (хондромиксоидные фибромы, хондробластомы и пр.) [22].
Опухоли мягких тканей, как правило, небольшого размера и по данным нашего исследования часто прилежали к кортикальному слою. Надо отметить, что в литературе данный признак ранее не отмечался и его следует учитывать при поиске образований. Также в литературе упоминается о выявлении данных опухолей в коже, подкожно [8, 16].
По результатам нашего исследования образования внутрикостной и мягкотканной локализации в большинстве случаев были однородной структуры и имели гиперинтенсивный МР-сигнал на Т2ВИ и равномерное интенсивное накопление контрастного препарата по данным МРТ, что сопоставимо с данными других авторов [23-24]. Таким образом, гиперинтенсивность большинства опухолей на Т2ВИ, в том числе в режиме жироподавления (STIR), и выраженное накопление контрастного препарата являются ключевыми МР-признаками данных опухолей и позволяют четко их визуализировать на фоне окружающих мягких тканей. Ограничением МРТ является невозможность быстрого сканирования обширных зон тела с получением изображений высокого качества. По данным КТ только опухоли мягких тканей интенсивно накапливали контрастный препарат во всех случаях, а опухоли костей его интенсивно накапливали лишь в 3 из 7 наблюдений, что, безусловно, влияет на выявляемость данных опухолей. Интенсивное накопление контрастного препарата в большинстве наблюдений при МРТ, в отличие от КТ, безусловно, повышает чувствительность метода МРТ по сравнению с КТ. Одним из актуальных и очень перспективных методов диагностики у данной категории пациентов является МРТ всего тела с применением Т2ВИ в режиме жироподавления (Т2 STIR) как приоритетной в выявлении образований и может использоваться как альтернатива радиоизотопным методам исследования в случае невозможности их проведения. Результаты использования диффузионно-взвешенных изображений как по данным литературы, так и в нашем исследовании противоречивы и требуется накопление большего количества наблюдений для уточнения диагностической точности данного метода [23].
Опухоли мягких тканей следует дифференцировать с множественными различными образованиями мягких тканей, такими как нейрофиброма, гемангиоэндотелиома, фиброма, нейрофибросаркома, гемангиома, лейомиома, гигантоклеточная опухоль, гигантоклеточная репаративная гранулема, теносиновит, ганглионарная киста, гистиоцитома, десмоидная опухоль и неврома [24].
Однако настороженность врача-эндокринолога в отношении ФМО на основании полученных специфических лабораторных показателей, которая, как правило, отражена в направлении на исследование, должна учитываться врачом-рентгенологом при поиске, выявлении и дальнейшей характеристике любой выявленной опухоли у пациента. Любая выявленная опухоль у пациента с фосфо- пенической остеомаляцией опухолевого генеза должна вызывать подозрение врача-рентгенолога в отношении ФМО.
Окончательный диагноз ставится на основании гистологического исследования послеоперационного материала, так как предоперационная биопсия не рекомендуется в связи с сообщениями о возможности метастазирования [25].
По данным литературы, методом первой линии диагностики являются радиоизотопные методы диагностики [26]. При выявлении по данным радио изотопных методов исследования образования для последующей более детальной оценки его локализации и распространенности целесообразно проведение МРТ КТ может использоваться как метод первичной топической диагностики в случае отсутствия радиоизотопных методов диагностики.
Ограничением нашего исследования является небольшое количество наблюдений и целесообразно дальнейшее накопление опыта.
Таким образом, при наличии клинических данных любое остеолитическое (остеосклеротическое) образование кости и мягкотканное образование при КТ и МРТ должно вызывать подозрение на ФРФ-опухоль.
Заключение
Фосфатурическая мезенхимальная опухоль может встречаться как в костях, так и в мягких тканях. Несмотря на тяжелые клинические проявления, подавляющее большинство опухолей являются доброкачественными и, как правило, удаление опухоли приводит к выздоровлению пациента. КТ и МРТ позволяют их выявить и в дальнейшем определить границы хирургической резекции. Опухоли костей чаще всего остеолитические (реже остеосклеротические или смешанные остеолитические и остеосклеротические), с преимущественно склерозированными ровными контурами, имеют узкую зону перехода, обычно содержат внутренний матрикс и часто не накапливают контрастный препарат по данным КТ.
В то же время опухоли мягкотканной локализации накапливают контрастный препарат при КТ- и МР-исследованиях. При этом по данным МРТ как внутрикостные, так и мягкотканные образования в большинстве случаев имеют гиперинтенсивный МР-сигнал на Т2ВИ и интенсивное накопление контрастного препарата, что, безусловно, повышает чувствительность метода по сравнению с КТ.
Использование нового, часто встречающегося диагностического признака- прилежание образований костей и мягкий тканей к кортикальному слою, и заострение внимания врачами-рентгенологами на данной зоне позволит снизить риск “пропустить” опухоль. Однако КТ и МРТ все же менее пригодны для обнаружения данных опухолей, в отличие от радиоизотопных методов диагностики (ПЭТ/КТ и сцинтиграфия), и должны использоваться на втором этапе диагностики.
Список литературы
Uramoto N., Furukawa M., Yoshizaki T. Malignant phosphaturic mesenchymal tumor, mixed connective tissue variant of the tongue. Auris Nasus Larynx. 2009; 36: 104-105
Ogose A., Hotta T., Emura I. et al. Recurrent malignant variant of phosphaturic mesenchymal tumor with oncogenic osteomalacia. Skelet. Radiol. 2001; 30: 99-103.
Гронская С.А., Голоунина О.О., Буклемишев Ю.В., Хайриева А.В., Дегтярев М.В., Рожинская Л.Я., Белая Ж.Е. Клинический случай фосфопенической формы остеомаляции вследствие паранеопластической секреции метастатического рака предстательной железы. Остеопороз и остеопатии. 2022; 25 (4): 43-51.
Gronskaya S.A., Golounina O.O., Buklemishev Y.V. et al. A clinical case of phosphopenic osteomalacia due to paraneoplastic secretion of metastatic prostate cance. Osteoporosis and Bone Diseases. 2022; 25 (4): 43-51
Folpe A.L., Fanburg-Smith J.C., Billings S.D. et al. Most osteomalacia-associated mesenchymal tumors are a single histopathologic entity: an analysis of 32 cases and a comprehensive review of the literature. Am. J. Surg. Pathol. 2004; 28 (1): 1-30.
Гронская С.А., Белая Ж.Е., Мельниченко Г.А. ФРФ23- индуцированная остеомаляция опухолевого генеза. Проблемы эндокринологии. 2022; 68 (5): 56-66.
Gronskaia S.A., Belaya Z.E., Melnichenko G.A. FGF23 tumor induced osteomalacia. Problemy Endokrinologii. 2022; 68 (5): 56-66.
Булычева И.В., Родионова С.С., Карпенко В.Ю., Колондаев А.Ф., Козлова Е.В., Буклемишев Ю.Е. Онкогенная остеомаляция/фосфатурическая мезенхимальная опухоль: клиническое наблюдение и обзор литературы. Саркомы костей, мягких тканей и опухоли кожи. 2022; 14 (1): 48-54.
Bulycheva I.V., Rodionova S.S., Karpenko V.Y. et al. Oncogenic osteomalacia/phosphaturic mesenchymal tumor: clinical case and literature review. Bone and soft tissue sarcomas, tumors of the skin. 2022; 14 (1): 48-54.
Еремкина А.К., Мирная С.С., Горбачева А.М., Паневин Т.С., Воронкова И.А., Мокрышева Н.Г. Случай гипофос- фатемической остеомаляции опухолевого генеза. Ожирение и метаболизм. 2020; 17 (2): 220-227.
Eremkina A.K., Mirnaya S.S., Gorbacheva A.M. et al. The case of oncogenic hypophosphatemic osteomalacia. Obesity and Metabolism. 2020; 17 (2): 220-227.
Гронская С.А., Белая Ж.Е., Рожинская Л.Я., Мельниченко Г.А., Дубовицкая ТА., Мамедова Е.О., Родионова С.С., Буклемишев Ю.В., Пигарова Е.А., Дегтярев М.В., Бабаева Д.М., Владимирова В.П., Тарбаева Н.В., Серженко С.С., Григорьев А.Ю., Дзеранова Л.К., Карпенко В.Ю., Карасев А.Л., Федотов Р.Н., Ульянова И.Н., Торопцова Н.В., Лесняк О.М., Мокрышева Н.Г., Дедов И.И. Клинические проявления, принципы диагностики и лечения фосфа- турических мезенхимальных опухолей, секретирующих фактор роста фибробластов 23: результаты наблюдения 40 случаев. Проблемы эндокринологии. 2023; 69 (5): 25-38
Gronskaia S.A., Belaya Z.E., Rozhinskaya L.Y. et al. Clinical features, diagnostics and treatment of FGF23 secreting tumors: series of 40 clinical cases. Problems of Endocrinology. 2023; 69 (5): 25-38.
Leaf D.E., Pereira R.C., Bazari H., Juppner H. Oncogenic osteomalacia due to FGF23-expressing colon adenocarcinoma. J. Clin. Endocrinol. Metab. 2013; 98 (3): 887-891.
Lin H.A., Shih S.R., Tseng Y.T. et al. Ovarian cancer-related hypophosphatemic osteomalacia-a case report. J. Clin. Endocrinol. Metab. 2014; 99 (12): 4403-4407.
Xie Y., Li H.Z. Oncogenic osteomalacia caused by renal cell carcinoma. J. Clin. Endocrinol. Metab. 2013. 98 (12): 4597-4598
Chong W.H., Andreopoulou P., Chen C.C. et al. Tumor localization and biochemical response to cure in tumor- induced osteomalacia. J. Bone Miner. Res. 2013; 28 (6): 1386-1398.
Minisola S., Fukumoto S., Xia W. et al. Tumor-induced osteomalacia: a comprehensive review. Endocrine Rev. 2023; 44 (2): 323-353.
Гребенникова Т.А., Умярова Д.Ш., Слащук К.Ю., Дегтярев М.В., Родионова С.С., Румянцев П.О., Белая Ж.Е. Фосфопеническая остеомаляция опухолевого генеза: клинический случай. Остеопороз и остеопатии. 2018; 21 (4): 24-28.
Grebennikova TA., Umiarova D.Sh., Slashchuk K.Y. et al. Tumor-induced osteomalacia: a dinical case report. Osteoporosis and Bone Diseases. 2018; 21 (4): 24-28.
Broski S.M., Folpe A.L., Wenger D.E. Imaging features of phosphaturic mesenchymal tumors. Skeletal. Radiol. 2019; 48 (1): 119-127.
Liu Y., He H., Zhang C. et al. Phosphaturic Mesenchymal Tumors: Rethinking the Clinical Diagnosis and Surgical Treatment. J. Clin. Med. 2022; 12 (1): 252.
Folpe A.L. Phosphaturic mesenchymal tumors: A review and update. Semin. Diagn. Pathol. 2019; 36 (4): 260-268.
Richardson A.L., Richardson O.K. Phosphaturic mesenchymal tumor: case report. Radiol. Case Rep. 2019; 14 (12): 1518-1524.
Ho C.L. Ga68-DOTA peptide PET/CT to detect occult mesenchymal tumor-inducing osteomalacia: a case series of three patients. Nucl. Med. Mol. Imaging. 2015; 49 (3): 231-236.
Kumar R., Folpe A.L., Mullan B.P. Tumor-induced osteomalacia. Transl. Endocrinol. Metab. 2015; 7(3): 1-24.
Benson J.C., Trejo-Lopez J.A., Nassiri A.M. et al. Phosphaturic mesenchymal tumor. Am. J. Neuroradiol. 2022; 43 (6): 817-822.
Broski S.M., Folpe A.L., Wenger D.E. Imaging features of phosphaturic mesenchymal tumors. Skeletal. Radiol. 2019; 48 (1): 119-127.
Nakanishi K., Sakai M., Tanaka H. et al. Whole-body MR imaging in detecting phosphaturic mesenchymal tumor (PMT) in tumor-induced hypophosphatemic osteomalacia. Magn. Reson. Med. Sci. 2013; 12 (1): 47-52.
Shi Z., Deng Y., Li X. et al. CT and MR imaging features in phosphaturic mesenchymal tumor-mixed connective tissue: a case report. Oncol. Lett. 2018; 15 (4): 49704978.
Jan de Beur S.M., Minisola S., Xia W.B. et al. Global guidance for the recognition, diagnosis, and management of tumor-induced osteomalacia. J. Internal Med. 2023; 293 (3): 309-328.
El-Maouche D., Sadowski S.M., Papadakis G.Z. et al. 68Ga-DOTATATE for tumor localization in tumor-induced osteomalacia. J. Clin. Endocrinol. Metab. 2016; 101 (10): 3575-3581.
Авторы:
Бурякина Светлана Алексеевна - канд. мед. наук, врач-рентгенолог референс-центра лучевой диагностики ФГБУ “НМИЦ эндокринологии” Минздрава России, Москва
Гронская Софья Александровна - аспирант отделения остеопороза и остеопатий, младший научный сотрудник лаборатории молекулярной онкоэндокринологии ФГБУ “НМИЦ эндокринологии” Минздрава России, Москва.
Тарбаева Наталья Викторовна - канд. мед. наук, заведующая референс-центром лучевой диагностики ФГБУ “НМИЦ эндокринологии” Минздрава России, Москва.
Белая Жанна Евгеньевна - доктор мед. наук, профессор, заведующая отделением остеопороза и остеопатии ФГБУ “НМИЦ эндокринологии” Минздрава России, Москва.j
Мокрышева Наталья Георгиевна - член-корр. РАН, доктор мед. наук, профессор, директор ФГБУ “НМИЦ эндокринологии” Минздрава России, Москва.
Теги: МРТ
234567 Начало активности (дата): 09.06.2025
234567 Кем создан (ID): 989
234567 Ключевые слова: КТ; МРТ; фосфатурическая мезенхимальная опухоль
12354567899
Похожие статьи
Опыт применения полика пролактона при производстве скаф фолда мениска коленного суставаРентген на дому 8 495 22 555 6 8
Особенности визуализации КТ и МРТ на приеме клинического случая рака билиарного тракта
КТ и МРТ стали доступнее: в Поморье расширяют парк современного диагностического оборудования
Эффективное сочетание методов артроскопической и малоинвазивной хирургии при хронической заднелатеральной нестабильности локтевого сустава



