 22.08.2025
22.08.2025
Идиопатическая подагра
Подагра — самый распространенный воспалительный артрит в мире.
Список сокращений
АД — артериальное давление
АГ — артериальная гипертензия
АКР — Американская коллегия ревматологов
АЛТ — аланинтрансаминаза
АСТ — аспартаттрансаминаза
ВАШ — визуально-аналоговая шкала
ВОЗ — Всемирная организация здравоохранения
ГИБП — генно-инженерные биологические препараты
ГК — глюкокортикоиды
ГУ — гиперурикемия
ДИ — доверительный интервал
ДЭКТ — двухэнергетическая компьютерная томография
ЕУЛАР —Европейский альянс ассоциаций ревматологов
ЖКТ - желудочно-кишечный тракт
ИБС — ишемическая болезнь сердца
ИЛ — интерлейкин
ИМТ — индекс массы тела
КТ — компьютерная томография
КСО - ксантиоксидаза
МК — мочевая кислота
МКБ — мочекаменная болезнь
МРТ — магнитно-резонансная томография
МС — метаболический синдром
МУН — моноурат натрия
НПВП — нестероидные противовоспалительные и противоревматические препараты
НГЛТ-2 — натрий-глюкозный котранспортер 2-го типа
НР — нежелательная реакция
НЛР - нежелательная лекарственная реакция
ОА — остеоартрит
ОР — отношение рисков
РА — ревматоидный артрит
РКИ — рандомизированные клинические исследования РФ — Российская Федерация
СД — сахарный диабет
СЖ — синовиальная жидкость
СКФ — скорость клубочковой фильтрации
рСКФ — расчетная скорость клубочковой фильтрации
СН — сердечная недостаточность
СРБ - С-реактивный белок
ССЗ — сердечно-сосудистые заболевания
ТГ — триглицериды
УЗИ — ультразвуковое исследование
УСТ - уратснижающая терапия
ФНО-а — фактор некроза опухоли-а
ФР — факторы риска
ХБП - хроническая болезнь почек
ХС - холестерин
ХС ЛПВП - холестерин липопротеинов высокой плотности
ХС ЛПНП - холестерин липопротеинов низкой плотности
ЦОГ - циклооксигеназа
ЭКГ - электрокардиография (регистрация электрокардиограммы; расшифровка, описание и интерпретация электрокардиографических данных)
ЭхоКГ - эхокардиография
Термины и определения
Артрит — воспаление тканей сустава, симптомы которого включают боль, покраснение, гипертермию, отек, ограничение подвижности и скованность.
Асимптоматическая (бессимптомная) гиперурикемия — гиперурикемия (ГУ) при отсутствии когда-либо имевших место клинических симптомов подагры (артрита). Гиперурикемия (ГУ) — сывороточный уровень мочевой кислоты (МК) выше пороговых значений, определенных в результате клинических и эпидемиологических исследований, продемонстрировавших связь с повышением риска кристаллизации уратов, развития подагры и целесообразность и пользу терапии, направленной на снижение ниже этих уровней. Генно-инженерные биологические препараты (ГИБП) — группа лекарственных средств биологического происхождения, в том числе моноклональные антитела (химерные, гуманизированные, полностью человеческие) и рекомбинантные белки (обычно включают Fc фрагмента IgG человека), полученные с помощью методов генной инженерии, специфически подавляющие иммуновоспалительный процесс и замедляющие прогрессирование деструкции суставов.
Глюкокортикоиды (ГК) — синтетические стероидные гормоны, обладающие естественной противовоспалительной активностью.
Доказательная медицина — надлежащее, последовательное и осмысленное использование современных наилучших доказательств (результатов клинических исследований) в сочетании с индивидуальным клиническим опытом и c учетом ценностей и предпочтений пациента в процессе принятия решений о состоянии здоровья и лечении пациента [1].
Заболевание — состояние, возникающее в связи с воздействием патогенных факторов, нарушение деятельности организма, работоспособности, способности адаптироваться к изменяющимся условиям внешней и внутренней среды при одновременном изменении защитно-компенсаторных и защитно-приспособительных реакций и механизмов организма [2].
Изменение образа жизни — мероприятия, направленные на нормализацию веса и характера питания, двигательной активности, ограничение потребления алкоголя, целью которых является снижение сывороточного уровня МК.
Исход — любой возможный результат, возникающий от воздействия причинного фактора, профилактического или терапевтического вмешательства, все установленные изменения состояния здоровья, возникающие как следствие вмешательства [3].
Клиническое исследование — любое исследование, проводимое с участием человека в качестве субъекта для выявления или подтверждения клинических и/или фармакологических эффектов исследуемых продуктов, выявления нежелательных реакций на исследуемые продукты и/или изучения их всасывания, распределения, метаболизма и выведения с целью оценить их безопасность и/или эффективность [4].
Конфликт интересов — ситуация, при которой у медицинского или фармацевтического работника при осуществлении ими профессиональной деятельности возникает личная заинтересованность в получении лично либо через представителя компании материальной выгоды или иного преимущества, которое влияет или может повлиять на надлежащее исполнение ими профессиональных обязанностей вследствие противоречия между личной заинтересованностью медицинского работника или фармацевтического работника и интересами пациента [2].
Кристаллы моноурата натрия (МУН) — натриевая соль МК, патогенные кристаллы при подагре (химическая формула CsHNNaOs).
Ксантиноксидаза (КСО) — фермент, катализирующий окисление гипоксантина в ксантин и ксантина в МК.
Лекарственные препараты — лекарственные средства в виде лекарственных форм, применяемые для профилактики, диагностики, лечения заболевания, реабилитации, для сохранения, предотвращения или прерывания беременности [5].
Медицинское вмешательство — выполняемые медицинским работником и иным работником, имеющим право на осуществление медицинской деятельности по отношению к пациенту, затрагивающие физическое или психическое состояние человека и имеющие профилактическую, диагностическую, лечебную, реабилитационную или исследовательскую направленность виды медицинских обследований и/или медицинских манипуляций, а также искусственное прерывание беременности [2].
Межприступный период — бессимптомный период после или между приступами подагрического артрита, несмотря на присутствие кристаллов МУН.
Мочевая кислота (МК) — конечный продукт метаболизма нуклеиновых кислот и пуриновых оснований у человека (химическая формула C5H4N4O3) под действием фермента ксантиноксидазы.
Нестероидные противовоспалительные и противоревматические препараты (НПВП) —
группа синтетических лекарственных средств, обладающих симптоматическим обезболивающим, жаропонижающим и противовоспалительным эффектами, связанными в первую очередь ингибицией активности циклооксигеназы — фермента, регулирующего синтез простагландинов.
Олигоартрит — артрит с вовлечением 1-4 суставов.
Острый артрит — артрит, развивающийся в течение нескольких часов или дней.
Пациент — физическое лицо, которому оказывается медицинская помощь или которое обратилось за оказанием медицинской помощи независимо от наличия у него заболевания и от его состояния [2].
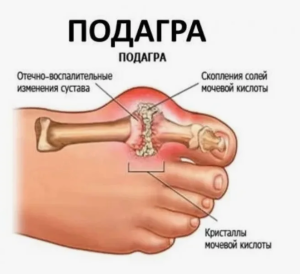
Подагра — хроническое аутовоспалительное заболевание, развивающееся в связи с воспалением в местах отложения кристаллов МУН у лиц с ГУ, обусловленной внешнесредовыми и/или генетическими факторами.
Подагрический артрит — клинически очевидный эпизод острого воспаления в суставе, вызванный кристаллами МУН.
Подкожный тофус — тофус, обнаруживаемый при физикальном осмотре.
Полиартрит — артрит c вовлечением >4 суставов.
Поляризационная микроскопия — метод изучения свойств гистологических структур, обладающих способностью двоякого лучепреломления (анизотропия), включая кристаллы, в поляризующем свете.
Рабочая группа по разработке/актуализации клинических рекомендаций — коллектив специалистов, работающих совместно и согласованно в целях разработки/актуализации клинических рекомендаций и несущих общую ответственность за результаты данной работы. Синдром — устойчивая совокупность ряда симптомов с единым патогенезом [6]. Синовиальная жидкость (СЖ) — обнаруживаемая в полостях суставов вязкая жидкость, продуцируемая выстилающими синовиальные суставы клетками.
Скорость клубочковой (гломерулярной) фильтрации (СКФ) — это количество миллилитров плазмы крови, профильтровавшейся во всех клубочках почек за одну минуту. Величина СКФ выражается в мл/мин, определяется величинами почечного плазмотока, фильтрационного давления, фильтрационной поверхности и зависит от массы действующих нефронов. Используется как интегральный показатель функционального состояния почек и стандартизуется на площадь поверхности тела (усредненная площадь поверхности тела составляет 1,73 м2).
Состояние — изменения организма, возникающие в связи с воздействием патогенных и/или физиологических факторов и требующие оказания медицинской помощи [2].
Тофус — очаговое скопление кристаллов МУН в тканях больного подагрой. Уратснижающие препараты — группа лекарственных средств, действие которых направлено на предупреждение образования и растворение имеющихся кристаллов МУН.
Ураты — циркулирующие в организме соли МК.
Уровень достоверности доказательств — степень уверенности в том, что полученный эффект от применения медицинского вмешательства является истинным [7].
Уровень убедительности рекомендаций — степень уверенности в достоверности эффекта вмешательства и в том, что следование рекомендациям принесет больше пользы, чем вреда в конкретной ситуации [7].
Хроническая болезнь почек (ХБП) — персистирующее в течение не менее трех месяцев поражение почек вследствие действия различных этиологических факторов, анатомической основой которого является процесс замещения нормальных анатомических структур фиброзом, приводящий к их дисфункции.
Хронический подагрический артрит — стойкое воспаление в суставе(ах), вызванное кристаллами МУН.
Целевой уровень МК сыворотки — уровень МК сыворотки, различный для разных групп пациентов с подагрой, достижение которого в результате лечения позволяет добиться растворения имеющихся и предотвращения образования новых кристаллов МУН.
1. Краткая информация по заболеванию или состоянию (группе заболеваний или состояний)
1.1. Определение заболевания или состояния (группы заболеваний, состояний)
Подагра — хроническое аутовоспалительное заболевание, развивающееся в связи с воспалением в местах отложения кристаллов моноурата натрия (МУН) у лиц с гиперурикемией (ГУ), обусловленной факторами внешней среды и/или генетическими факторами [8].
1.2. Этиология и патогенез заболевания или состояния (группы заболеваний, состояний)
Предрасполагающие факторы
Облигатным фактором риска (ФР) развития подагры является наличие ГУ. Последняя определяется как повышение сывороточного уровня МК > 6,8 мг/дл (> 404 мкмоль/л), при котором происходит образование кристаллов МУН в физиологических условиях (температура 370С) [9]. Формирование кристаллов МУН возможно и при более низком уровне показателя (> 6,0 мг/дл (> 360 мкмоль/л) при температуре 350С) [10].
Чем выше сывороточный уровень МК, тем выше риск развития подагры. Отмечается прямая, но не линейная зависимость: при сывороточном уровне МК < 6 мг/дл (<360 мкмоль/л) 15-летний кумулятивный риск развития подагры составляет 1,12%, при уровне в пределах 6,0-6,9 мг/дл — 3,7%, а при уровне > 10 мг/дл (> 600 мкмоль/л) — 48,57% [11]. Из всех пациентов с асимптоматической ГУ только у 10-15% в конечном итоге развивается подагра [12].
Причины избирательной трансформации асимптоматической ГУ в подагру неизвестны, однако, ряд факторов, ассоциирующихся с ГУ, тесно и независимо связаны с большим риском развития подагры.
Возраст — увеличение возраста ассоциировано с повышением риска развития подагры, начиная с взрослого возраста у мужчин и постменопаузального возраста у женщин [13].
Мужской пол — распространенность подагры у женщин намного уступает таковой у мужчин, и основной причиной этого считается эффект эстрогенов, оказывающих выраженное урикозурическое действие, которое теряется после развития менопаузы [14, 15].
Генетическое факторы — их наличие связано с сывороточным уровнем уратов и включает сотни описанных генетических вариантов [16, 17].
Избыточная масса тела и ожирение — имеется прямая, независимая от других факторов связь между индексом массы тела (ИМТ) и риском развития подагры [13].
Повышение артериального давления (АД) — уровень заболеваемости подагрой в три раза выше у пациентов с артериальной гипертензией (АГ), чем у пациентов с нормальным АД [13].
Потребление алкоголя — уровни МК в сыворотке крови и риск развития подагры увеличиваются пропорционально увеличению потребления пива или крепких спиртных напитков, независимо от других факторов, включая диетические [18, 19].
Потребление большого количества богатых пуринами продуктов — уровень МК в сыворотке и риск развития подагры повышается параллельно увеличению общего потребления мяса или морепродуктов [19].
Потребление фруктозосодержащих напитков — потребление сладких безалкогольных напитков дозозависимо связано с увеличением риска развития подагры [20].
Прием мочегонных препаратов — применение любых диуретиков, особенно тиазидных и петлевых, независимо связано с увеличением риска развития подагры [21].
Хроническая болезнь почек (ХБП) — снижение функции почек, независимо от других факторов, включая прием диуретиков, многократно увеличивает риск заболеваемости подагрой, особенно у пациентов с терминальной стадией почечной недостаточности, в том числе у получающих гемодиализ [22, 23].
Наиболее важный патогенетический механизм развития клинических проявлений подагры связан с индукцией кристаллами МУН острого воспаления в местах их формирования [24, 25]. При подагре кристаллы МУН, формирующиеся в синовиальной жидкости (СЖ) и близлежащих тканях, выступают в качестве триггера острого артрита, запуская каскад иммунных реакций. Исходно происходит фагоцитоз кристаллов, которые индуцируют активацию внутриклеточных структур, инфламмасом, внутриклеточных цитозольных мультибелковых олигомерных комплексов, ответственных за активацию иммунного ответа, в результате чего синтезируется широкий спектр провоспалительных цитокинов, хемокинов (прежде всего ИЛ-1 (ИЛ-1), а также ИЛ-6, ИЛ-8, ИЛ-18, фактора некроза опухоли-а (ФНО-а) и др.). Их продукция способствует развитию острой массивной воспалительной реакции, вазодилатации, быстрой миграции к месту воспаления иммунных клеток, преимущественно нейтрофилов. Это проявляется острым приступом артрита, основным клиническим проявлением подагры.
1.3. Эпидемиология заболевания или состояния (группы заболеваний, состояний)
Стандартизированная по возрасту заболеваемость подагрой в мире в среднем составляет (95% ДИ: 81,3, 104,1) случаев на 100 000 населения в год, с колебанием в различных регионах от 48,2 до 190 случаев.
Распространенность — 510,6 (95% ДИ: 455,6, 570,3) случаев на 100 000 населения с колебаниями от 231,4 до 1 394 случаев, — увеличилась в период с 1990 г. по 2017 г. на 7,2% (95% ДИ: 6,4, 8,1). В развитых странах распространенность подагры колеблется от < 1% до 6,8%. Пик заболеваемости у мужчин — 40-50 лет, у женщин — после 60 лет (в постменопаузальном периоде). Распространенность подагры нарастает с возрастом, среди мужчин встречается в 3-7 раз чаще, но в старческом возрасте различия уменьшаются до 23-кратного превосходства у мужчин [26, 27].
Подагра — самый распространенный воспалительный артрит в мире. Согласно расчетам, на 2017 г. в мире насчитывалось около 41,2 миллиона взрослых с пациентов с подагрой, что более чем вдвое больше страдающих ревматоидным артритом [28].
Подагра связана с повышенным риском смерти от сердечно-сосудистых заболеваний (ССЗ) [29], а также некардиальных причин [30]. Общий высокий риск преждевременной смертности при подагре не меняется в лучшую сторону более двух десятилетий [31]. Бремя подагры усугубляется частым сочетанием с сопутствующими заболеваниями, в том числе артериальной гипертензией (АГ) (75%), ХБП (70%), ожирением (53%) и ССЗ (10-14%), каждое из которых также связано с повышенным риском заболеваемости и смертности [32].
1.4. Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
М10.0 — Идиопатическая подагра Подагрический бурсит Первичная подагра
Подагрические узлы [уратные тофусы] в сердце f (143.8*)
1.5. Классификация заболевания или состояния (группы заболеваний, состояний) Классификация по стадии заболевания
В развитии и прогрессировании подагры выделяют 4 стадии [33]:
Бессимптомная ГУ с отсутствием депозитов кристаллов МУН (у пациента повышенный сывороточный уровень МК, но отсутствуют кристаллы МУН).
Бессимптомная ГУ с наличием депозитов кристаллов МУН, но без симптомов или анамнеза подагры (отсутствие приступов артрита и тофусов).
Депозиты МУН с текущим (острый подагрический артрит) или предшествующим эпизодом подагрического артрита (межприступный период при отсутствии артрита на текущий момент).
Хроническая тофусная подагра (пациенты с тофусами, хроническим артритом, эрозиями по данным методов лучевой диагностики, функциональными нарушениями).
1.6. Клиническая картина заболевания или состояния (группы заболеваний, состояний)
В подавляющем большинстве случаев подагра проявляется типичной симптоматикой, характеризующейся кратковременными (от нескольких дней до 2 недель), проходящими самостоятельно острыми приступами моно- или олигоартрита, которые сопровождаются сильнейшей болью, припухлостью, гиперемией, гипертермией сустава или суставной бурсы, а также ограничением функции пораженного сустава.
В межприступный период какие-либо жалобы отсутствуют. В некоторых случаях, в основном при длительном течении, заболевание проявляется хроническим артритом, полиартритом.
Другим поздним клиническим признаком подагры является очаговое накопление кристаллов уратов с образованием подкожных тофусов, обнаруживаемых при объективном осмотре.
2. Диагностика заболевания или состояния (группы заболеваний или состояний), медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза — классификационные критерии American College of Rheumatology/ European League Against Rheumatism (ACR/EULAR) (Приложение Г1). Диагноз подагры устанавливается либо при визуальном обнаружении кристаллов МУН в СЖ или содержимом тофуса, либо при наличии совокупности клинических, лабораторных и инструментальных признаков заболевания, рассчитываемых в баллах. Согласно критериям, если баллов 8 и более, заболевание может быть классифицировано как подагра.
2.1 Жалобы и анамнез
Рекомендуется выявлять ФР и сопутствующие заболевания у каждого пациента с диагнозом подагра, включая ожирение, гипергликемию, гиперлипидемию, артериальную гипертензию, заболевания почек и метаболический синдром (МС), ССЗ, семейный анамнез подагры [34, 35].
УУР C, УДД 5
Комментарии. Относительный риск развития подагры у больных с хронической болезнью почек, ожирением, при повышении АД, нарушениях липидного обмена намного выше популяционного, что является одной из причин высокого уровня смертности у больных подагрой [36-40]. При наличии подагры и ГУ чаще регистрируются случаи терминальной почечной недостаточности, а смертность у больных с хронической болезнью почек при наличии подагры увеличивается четырехкратно [41, 42]. Наличие ожирения отождествляется с более ранним возрастом дебюта подагры и поражением большего числа суставов [43]. Сбор данных включает сведения о наличии семейного анамнеза подагры, анамнеза ожирения, ССЗ, ХБП, АГ, образе жизни, приеме лекарственных препаратов (таблица П3, Приложение А3.1).
Рекомендуется выявлять у каждого пациента с подагрой триггерные факторы развития приступов подагрического артрита: злоупотребление алкоголем, потребление сахаросодержащих (фруктозосодержащих) напитков и продуктов питания [39, 44-46].
УУР B, УДД 2
Комментарии. Должны быть проанализированы пищевые привычки, включая потребление фруктозосодержащих напитков, пуриносодержащих продуктов (мясо красных сортов, рыба, морепродукты), прием алкоголя, вклад которых в развитие подагры показан в нескольких популяционных исследованиях и метаанализах [18, 20, 47-54] (таблица П3, Приложение А3.1).
У каждого пациента с подагрой рекомендуется определять ФР развития данного заболевания, связанные с приемом следующих лекарственных препаратов: диуретики, ацетилсаллициловая кислота• ** в низких дозах, циклоспорин**, такролимус**, противотуберкулезные препараты [34, 44, 55].
УРР С, УДД 5
Комментарии. Петлевые и тиазидные диуретики увеличивают реабсорбцию МК с почками и приводят к ГУ и возрастанию риска развития подагры, который сохраняется длительно даже после их отмены, способствуют быстрому росту тофусов [56]. По данным проспективных исследований, прием некоторых иммунодепрессантов (цитостатических препаратов) (такролимус** и циклоспорин**) приводит к быстрому развитию подагры [57]. Прием противотуберкулезных препаратов (прежде всего пиразинамида** и этамбутола** или комбинации пиразинамида, рифампицина и изониазида (изониазид + пиразинамид + рифампицин**, изониазид + пиразинамид + рифампицин + этамбутол**, изониазид + пиразинамид + рифампицин + этамбутол + пиридоксин**) приводит к существенному увеличению сывороточного уровня МК, хотя неизвестно, насколько они влияют на риск развития подагры [58, 59].
Прием ацетилсалициловой кислоты** в низких дозировках (60-300 мг/сут) снижает экскрецию МК и может вызвать ГУ, тогда как более высокие дозы оказывают урикозурический эффект [60].
Рекомендуется в каждом случае при подозрении на диагноз подагры давать клиническую характеристику артрита (локализация артрита, время до появления максимальной боли и воспаления, продолжительность приступа, наличие приступа (- ов) артрита в анамнезе) для выявления характерных симптомов заболевания [44, 61, 62].
УРР С, УДД 5
Комментарии. Внезапная атака артрита с быстрым развитием выраженной боли и воспаления, которые достигают максимума в течение 24 часов, особенно сопровождающиеся сильным отеком и эритемой, высоко подозрительны в отношении микрокристаллического воспаления, прежде всего подагры, хотя и не специфичны для нее; при этом если типичный приступ острого артрита затрагивает суставы стоп, особенно 1-й плюснефаланговый и голеностопный, количество приступов острого артрита превышает один (наличие аналогичных эпизодов острого артрита), имеется принадлежность к мужскому полу, а продолжительность острого приступа артрита не превышает двухнедельный срок, это увеличивает вероятность наличия у пациента подагры [36, 61, 63]. В исследованиях, проводимых для формирования классификационных критериев [62], данные признаки являются основными клиническими «маркерами» острого артрита при подагре. Тем не менее при высокой чувствительности уровень доказательности данной рекомендации не максимален. Например, артрит 1-го плюснефалангового сустава, позволивший классифицировать его как подагрический исключительно на основании клинической картины, подтверждается только в 77% случаев [64]. Наличие же только одного из перечисленных клинических признаков (поражение 1-го плюснефалангового сустава, суставов стоп, острое начало с развитием максимальной боли и воспаления, анамнестические данные о наличии острых приступов артрита) недостаточно для постановки диагноза подагры.
2.2. Физикальное обследование
Рекомендуется у всех пациентов с артритом, помимо визуальной оценки наличия артрита (видимая глазом припухлость, гиперемия, функциональное состояние суставов), отдельно осматривать места возможной локализации подкожных тофусов (наиболее часто это ушные раковины, 1-е пальцы стоп, локтевые суставы); пальпаторно определять болезненные и воспаленные суставы, включая измерение объема сустава, размеры тофусов (при их наличии) [61, 62].
УРР С, УДД 2
Комментарии. Пальпаторно определяемые подкожные тофусы чаще локализованы в местах, подверженных давлению или трению, при формировании в области мелких суставов кистей могут симулировать узелковую форму ОА, узлы при РА, при этом в области ушных раковин они обнаруживаются в 12% случаев, чаще у мужчин, а у пациентов, которые принимают ГК, формирование подкожных тофусов происходит быстрее [63, 65, 66]. В некоторых случаях подкожные тофусы могут быть первым клиническим проявлением заболевания, но чаще всего относятся к поздним симптомам подагры (в среднем формируются через 7-10 лет после дебюта подагры) [67]. •
Всем пациентам с подагрой рекомендуется определение индекса массы тела (ИМТ) для выявления избыточной массы тела/ожирения и измерение АД [34, 35, 44, 68]. УУР C, УДД 5
Комментарии. Объективное исследование пациента с подагрой направлено на выявление ФР заболевания, среди которых ожирение, выявляемое с помощью показателей антропометрии (расчет индекса массы тела по формуле, ИМТ по формуле
Кетле (отношение массы тела в килограммах к длине тела в метрах, возведенной в квадрат (кг/м2)), а также АГ занимают ведущее место [40, 69]. В таблице П3, Приложении А3.2 суммированы основные положения и требования к клиническому обследованию пациента.
Всем пациентам с подагрой рекомендуется проведение общетерапевтического осмотра для выявлений сопутствующих заболеваний, оценки общего состояния и выявления сердечно-сосудистых ФР, включая почечную недостаточность, ишемическую болезнь сердца, сердечную недостаточность, инсульт, заболевания периферических артерий, ожирение, гипертонию, диабет [70].
УУР С, УДД 5
Комментарии. Общетерапевтический осмотр необходим для выявления признаков хронических и острых заболеваний, ФР их развития, а также определения медицинских показаний к выполнению дополнительных обследований и приемов (осмотров, консультацией) врачей-специалистов для уточнения диагноза заболевания (состояния).
2.3. Лабораторные диагностические исследования
Рекомендуется всем пациентам с подозрением на подагру, в том числе пациентам с недиагностированным воспалительным артритом, проводить пункцию синовиальной сумки сустава) или пункцию синовиальной сумки сустава под контролем ультразвукового исследования или биопсию узлов (тофусов) с последующим исследованием химических свойств синовиальной жидкости в поляризационном микроскопе или патолого-анатомического исследования биопсийного материала с целью определения кристаллов МУН [34, 35, 44, 62, 71, 62].
УУР А, УДД 2
Комментарии. Специфичность метода поляризационной микроскопии для демонстрации кристаллов крайне высока (близка к 100%), что позволяет считать метод золотым стандартом диагностики подагры, тогда как максимальная специфичность различных комбинаций клинических признаков подагры не превышает 88,5%, а чувствительность — 70% [72]. Тем не менее отсутствие кристаллов МУН в СЖ не позволяет полностью исключить диагноз подагры (чувствительность метода составляет только 70%) [73-75]. Диагностика подагры без поиска кристаллов МУН остается неточной, подчеркивая важность изучения СЖ для диагностических целей в рутинной клинической практике. Так как атипичные проявления подагры не редкость, а идентификация кристаллов позволяет поставить точный диагноз подагры, необходимо исследование СЖ во всех случаях недиагностированного воспалительного процесса [44]. Имеющиеся данные показывают, что подагра — наиболее частая причина недифференцированного острого артрита [63, 76-78].
Рекомендуется всем пациентам с отсутствием артрита на момент осмотра проведение пункции синовиальной сумки сустава или пункции синовиальной сумки сустава под контролем ультразвукового исследования в межприступный период (в этом случае желательно проводить пункцию сустава, воспаленного ранее), так как идентификация кристаллов МУН из невоспаленного сустава позволяет диагностировать подагру в межприступном периоде, хотя вероятность их обнаружения в этом случае несколько меньше [75].
УУР С, УДД 4
Комментарии. СЖ может быть получена не только из воспаленного, но и из интактного на данный момент, но ранее поражавшегося сустава (вероятность выявления кристаллов МУН превышает 70%), а также из ранее не пораженного сустава. В последнем случае вероятность выявления кристаллов МУН у пациентов, соответствующих клиническим критериям подагры, достигает 40% [72].
Рекомендуется всем пациентам с подозрением на септический артрит выполнить микробиологическое (культуральное) исследование СЖ на аэробные и факультативно-анаэробные микроорганизмы (Streptococcus pyogenes и т.д.) для подтверждения или опровержения диагноза септического артрита даже в случае идентификации кристаллов МУН [34, 80, 81].
УУР C, УДД 4
Комментарии. По популяционным данным вероятность развития септического артрита при подагре почти в три раза выше, чем в случае отсутствия данного диагноза [80, 81]. Схожесть клинической картины подагры и септического артрита нередко не дает возможность устанавливать диагноз, основываясь только на клинических данных. •
Рекомендуется у всех пациентов с подозрением на подагру проводить исследование уровня МК в крови с целью выявления ГУ [34, 62, 71, 82-85].
УУР С, УДД 4
Комментарии. Эпидемиологические исследования показывают взаимосвязь между повышенными уровнями МК сыворотки и подагрой [11, 13, 83, 84], и на настоящий момент ГУ является единственным доказанным облигатным ФР развития заболевания. В качестве диагностического маркера используется максимальный сывороточный уровень МК из имеющихся [62].
Не рекомендуется устанавливать диагноз подагры только на основании наличия ГУ [34, 61, 71, 82].
УУР C, УДД 5
Комментарии. Далеко не все пациенты с ГУ страдают подагрой или разовьют подагру [11, 13, 83, 84], а во время острого приступа подагрического артрита сывороточный уровень МК может быть нормальным [62]. Чем ниже сывороточный уровень МК, тем меньше шансов обнаружить у пациента подагру, но однократно полученное нормальное его значение не позволяет отвергнуть диагноз. ГУ должна рассматриваться исключительно как серьезный ФР возникновения подагры, а не как суррогатный маркер диагноза.
При отсутствии возможности проведения поляризационной микроскопии для установления диагноза подагры рекомендуется использовать совокупность клинических симптомов, данных лабораторных исследований и методов лучевой диагностики [44].
УУР C, УДД 5
Комментарии. Учитывая недостаточную распространенность метода, отсутствие соответствующей аппаратуры (поляризационного микроскопа) и обученных специалистов для проведения анализа СЖ, возможно ориентироваться на критерии подагры, принимая во внимание их высокую чувствительность и специфичность [61, 65]. •
Всем пациентам с подагрой для выявления характерных признаков воспаления рекомендуется проведение общего (клинического) анализа крови развернутого [86, 87].
УУР C, УДД 4
Комментарии. Острый приступ подагры может характеризоваться изменениями в клиническом анализе крови и характеризуется развитием лейкоцитоза, нейтрофилеза, повышением скороскти оседания эритроцитов (СОЭ) [86, 87].
Для выявления преддиабета, сахарного диабета (СД) всем пациентам с подагрой рекомендуется исследование уровня глюкозы в крови и исследование уровня гликированного гемоглобина (HbAlc) в крови [88-92].
УУР B, УДД 3
Комментарии. Нарушения углеводного обмена, в частности СД 2, обнаруживаются у пациентов с подагрой и ГУ достоверно чаще, чем в популяции, при этом ГУ рассматривается как один из возможных ФР СД 2 [93-95]. При значениях глюкозы крови > 6,1 ммоль/л следует повторно определить ее уровень во всех случаях, кроме несомненной гипергликемии с острой метаболической декомпенсацией или очевидными симптомами. В качестве диагностического теста возможно определение ИЪЛ1с [90, 91]. Значения перечисленных параметров оценки гликемии выше нормальных, но ниже диабетических, указывают на наличие предиабета. НвА1с может быть использован для диагностики СД и предиабета, если метод его определения сертифицирован в соответствии с National Glycohemoglobin Standartization Program (NGSP) или International Federation of Clinical Chemistry and Laboratory Medicine (IFCC) и стандартизован в соответствии с референсными значениями, принятыми в Diabetes Control and Complications Trial (DCCT) [96, 97]. Повышенный уровень HbA1c у пациентов с подагрой ассоциируется с высоким риском ССЗ [91].
В сомнительных случаях для уточнения диагноза СД, а также выявления преддиабета, рекомендуется проведение перорального глюкозотолерантного теста (ПТГТ) [89]. УУР В УДД 3
Комментарии. ПГТТ является единственным способом выявления нарушения толерантности к глюкозе как одного из вариантов предиабета [90]. Применение данного теста приводит к увлечению частоты выявления СД 2 у пациентов с подагрой в среднем на 34% [94]. •
Исследование уровня С-реактивного белка (СРБ) в сыворотке крови количественным методом рекомендуется всем пациентам с подагрой с целью проведения дифференциальной диагностики с другими заболеваниями суставов и оценки активности воспаления [70, 86, 87, 98, 99]
УУР C, УДД 4
Комментарии. СРБ - классический острофазовый белок сыворотки крови, являющийся наиболее чувствительным лабораторным биомаркером воспаления, инфекции и тканевого повреждения. У пациентов с ранним недифференцированным артритом определение уровня СРБ способствует правильной постановке диагноза [70]. У пациентов с подагрой уровень СРБ выше популяционного и снижается при назначении противовоспалительных и уратснижающих препаратов [86, 100].
Всем пациентам с подагрой для выявления нарушения функции почек рекомендуется исследование уровня креатинина в крови и расчет скорости клубочковой фильтрации (СКФ) [44, 70, 83, 101-105].
УУР C, УДД 5
Комментарии. Подагра и ГУ являются независимыми ФР ХБП, и, напротив, наличие почечной недостаточности способствует риску развития подагры и ГУ [101-103]. Вычисление СКФ проводится по формуле Chronic Kidney Disease Epidemiology (CKD- EPI), в мл/мин/1,73м2 [102] в специальных калькуляторах (Таблица П3, Приложение А3.3).
Всем пациентам с подагрой рекомендуются исследование уровня холестерина (ХС) в крови, исследование уровня холестерина липопротеинов высокой плотности в крови (ЛПВП), исследование уровня холестерина липопротеинов низкой плотности (ЛИНИ), а также исследование уровня триглицеридов в крови для оценки сердечнососудистого риска [106, 107].
УУР В, УДД 3
Комментарии. ГУ и подагра ассоциированы с повышенным сердечно-сосудистым риском. Повышенный уровень МКувеличивает развития дислипидемии, в том числе высокого уровня ХС ЛПНП, а также гипертриглицеридемии.
Определение отношения ТГ к ЛПВП продемонстрировало высокую прогностическую ценность так же, как и определение индекса атерогенности [106].
Всем пациентам с подагрой для выявления заболеваний почек рекомендуется проводить общий (клинический) анализ мочи [44, 108].
УУР C, УДД 4
Комментарии. Выполняется у всех пациентов с подагрой в связи с тем, что повреждение почек является значимым негативным прогностическим фактором при подагре, наличием доказанной связи между выявлением альбуминурии и повышением сердечно-сосудистой смертности [101, 102, 109]. •
Для выявления противопоказаний, потенциальных ФР развития нежелательной лекарственной реакции (НЛР) перед назначением терапии (всех групп препаратов)
всем пациентам с подагрой рекомендуется проводить лабораторное обследование в следующем объеме [44, 108]:
общий (клинический) анализ крови развернутый;
общий (клинический) анализ мочи;
анализ крови биохимический общетерапевтический (включающий определение МК, АЛТ, АСТ, креатинина, глюкозы);
определение СКФ (исследование функции нефронов по клиренсу креатинина (проба Реберга) или расчет по формуле CKD-EPI).
УУР С, УДД 5
Внутрикожную пробу с туберкулезным аллергеном, очаговую пробу с туберкулином, исследование уровня интерферона-гамма на антигены Mycobacterium tuberculosis complex в крови рекомендуется проводить всем пациентам с подагрой с целью выявления противопоказаний, потенциальных ФР развития НЛР перед назначением ГИБП (ингибиторы ИЛ-1) и каждые 6 месяцев на фоне лечения ГИБП (ингибиторы ИЛ-1) [110-113].
УУР В, УДД 1
Исследование уровня хорионического гонадотропина (свободная бета-субъединица) в сыворотке крови рекомендуется проводить женщинам фертильного возраста с подагрой перед назначением уратснижающих препаратов, запрещенных к применению в период гестации и кормления грудью [114-117].
УУР С, УДД 5
Комментарии. Исследование уровня хорионического гонадотропина (свободная бета-субъединица) в сыворотке крови может быть простым методом диагностики беременности при невозможности ультразвукового исследования.
Применение препаратов, ингибирующих синтез МК (ингибиторов ксантиноксидазы (КСО)) (аллопуринол• ** и фебуксостат)) относится к категории действия на плод по FDA - С, и назначение данных препаратов при беременности нежелательно [114-117].
2.4. Инструментальные диагностические исследования
Проведение УЗИ суставов рекомендуется всем пациентам с подозрением на подагру при невозможности исследования СЖ методом поляризационной микроскопии [44, 71, 85, 118].
УУР C, УДД 1
Комментарии. Учитывая, что метод может быть использован для ранней диагностики подагры, в том числе на преклинической стадии заболевания, так как у части пациентов с ГУ типичные ультразвуковые признаки подагры («двойной контур», вид «метели» в СЖ, гиперэхогенные гетерогенные повреждения, окруженные анэхогенными краями (тофусы)) могут выявляться раньше, чем болезнь манифестирует острым приступом артрита, УЗИ представляет большой интерес для диагностики подагры по причине низкой стоимости, широкой доступности и безопасности. [119, 120]. Включение метода в современные классификационные критерии подагры позволило увеличить их чувствительность с 0,85 до 0,92 и специфичность с 0,78 до 0,89 [62].
Проведение рентгенографии плюсны и фаланг пальцев стоп и/или кистей рекомендовано всем пациентам с подозрением на наличие подагры для определения рентгенологических признаков подагры [35, 62].
УУР С, УДД 5
Комментарии. Типичные рентгенографические признаки подагры включают: эрозии костей с выступающими краями и склеротическим ободком; сужение суставной щели, которые возникают на поздних стадиях болезни; образования мягких тканей, иногда кальцинированные, соответствующие тофусам мягких тканей. Но эти изменения, как правило, определяются спустя несколько лет после дебюта заболевания, малоинформативны в ранней диагностике подагры, не всегда выявляются даже у пациентов с хроническим артритом и относятся к поздним проявлениям болезни, хотя крайне редко могут формироваться в первые годы от начала заболевания [67]. Формирование внутрикостных тофусов часто происходит одновременно с подкожными тофусами, поэтому рентгенологическое исследование используется и для определения тяжести тофусного поражения [75, 121]. Выполнение рентгенографии оправдано для проведения дифференциального диагноза с травмами, другими заболеваниями костно-мышечной системы и т. д. •
Всем пациентам с подагрой рекомендуется проведение УЗИ почек с целью оценки размеров, структуры почек и наличия нефролитиаза [44, 62, 122, 123].
УУР С, УДД 5
Комментарии. Поражение почек при подагре встречается у большей части больных подагрой, не ограничивается нефролитиазом и характеризуется развитием атрофии канальцев, дегенерации сосудов почек и нефросклерозом [104, 124, 125].
В случае отсутствия возможности проведения УЗИ суставов или наличия сомнительных признаков подагры на УЗИ рекомендовано всем пациентам с подозрением на подагру проведение двухэнергетической компьютерной томографии (ДЭКТ) для верификации депозитов уратов [44, 62, 85, 126].
УУР В, УДД 1
Комментарии. В соответствии с классификационными критериями подагры ДЭКТ входит в перечень возможных диагностических процедур, однако из-за дороговизны метод не нашел широкого распространения. ДЭКТ имеет высокую диагностическую точность при установленной подагре, но низкую диагностическую ценность у пациентов с недавно начавшейся подагрой [65, 126-127]. Согласно результатам метаанализа специфичность ДЭКТ в отношении выявления признаков депонирования кристаллов МУН не превышает таковую для УЗИ суставов, а чувствительность УЗИ выше, чем у ДЭКТ [128].
Рентгенографию органов грудной клетки рекомендуется проводить всем пациентам с подагрой перед назначением ГИБП (ингибиторы ИЛ-1) c целью выявления поражения органов дыхания и сопутствующих заболеваний легких [110].
УУР С, УДД 5
Эзофагогастродуоденоскопию (ЭГДС) рекомендуется выполнять всем пациентам с подагрой (не реже 1 раза в год), регулярно получающим НПВП и/или ГК, при наличии анемии с целью исключения эрозивно-язвенного поражения желудка и двенадцатиперстной кишки [-129 - 131].
УУР С, УДД 5
Электрокардиографию (ЭКГ) (регистрация электрокардиограммы; расшифровка, описание и интерпретация электрокардиографических данных) рекомендуется проводить всем пациентам с подагрой не реже 1 раза в год [132, 133].
УУР В, УДД 2
Комментарии. У пациентов с подагрой частота развития нарушения внутрисердечной, проводимости, повреждение миокарда, сердечной недостаточностью выше чем в популяции [134-136]. ЭКГ используется в качестве стандартного метода диагностики скрининговой патологии сердечно-сосудистой системы.
Эхокардиографию (ЭхоКГ) рекомендуется проводить пациентам с подагрой при подозрении на наличие хронической сердечной недостаточности, поражения сердца, связанных с атеросклерозом [133, 137 - 141].
УУР В, УДД 2
Рентгеноденситометрия поясничного отдела позвоночника и рентгеноденситометрия проксимального отдела бедренной кости рекомендуются всем пациентам с подагрой каждые 12 месяцев при наличии следующих показаний [142, 143]:
возраст старше 50 лет для женщин и 60 лет для мужчин;
ранняя менопауза у женщин;
масса тела менее 60 кг;
прием ГК (более 3 месяцев в дозе более 5 мг/сут).
УУР С, УДД 5
2.5. Иные диагностические исследования
Прием (осмотры, консультации) врачей-специалистов рекомендуются с целью диагностики или определения тактики лечения заболеваний, которые могут оказать влияние на выбор терапии и прогноз у пациентов с подагрой [133, 144 - 148]:
врача-кардиолога — при развитии ССЗ на фоне прогрессирования и/или терапии подагры;
врача-эндокринолога — для диагностики заболеваний эндокринной системы, главным образом, СД, что может повлиять на выбор терапии при подагре;
врача-гастроэнтеролога — при развитии гастороэнтерологических осложнений на фоне лечения подагры;
врача-фтизиатра — при назначении ГИБП в случае подозрения на наличие латентной туберкулезной инфекции;
врача-онколога — при развитии злокачественных новообразований и для диагностики злокачественных новообразований и разработки тактики ведения пациентов;
врача-невролога — для диагностики туннельных синдромов, миелопатии, невропатии и других неврологических патологий на фоне подагры;
врача-нефролога — для диагностики и лечения ХБП, мочекаменной болезни (МКБ) и других заболеваний почек на фоне подагры;
врача травматолоаг-ортопеда — пациентам с подагрой, имеющим показания к хирургическому лечению (значительное нарушение функций суставов стоп,
кистей, коленных суставов и др., включая наличие тофусов, контрактуры, анкилоза, остеонекроза) или ортезированию;
врача по медицинской реабилитации — для разработки индивидуализированной схемы реабилитационных мероприятий;
врача-клинического фармаколога — в случаях выявления серьезных, непредвиденных нежелательных лекарственных реакций, связанных с применением лекарственных препаратов; необходимости назначения лекарственных препаратов с ожидаемо высоким риском развития серьезных нежелательных лекарственных реакций; назначения комбинаций лекарственных препаратов, усиливающих частоту нежелательных лекарственных реакций, а также необходимости одномоментного назначения больному пяти и более наименований лекарственных препаратов или свыше десяти наименований при курсовом лечении (полипрагмазии);
врача-диетолога — пациентам с подагрой в комбинации с хроническими заболеваниями эндокринной, сердечно-сосудистой и пищеварительной систем (например, при СД, язве желудка и т. Д.);
врача акушера-гинеколога — пациенткам, планирующим беременность или беременным с целью выработки тактики лечения и родовспоможения.
УУР С, УДД 5
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
3.1. Консервативное лечение
Консервативное лечение подагры рекомендовано всем без исключения пациентам и включает следующие компоненты [149 - 153]:
3.1.1. Симптоматическое лечение, направленное на купирование приступа артрита.
Уратснижающую терапию (УСТ), цель которой — поддержание целевого уровня
МК сыворотки.
Профилактику приступов артрита при инициации УСТ.
Немедикаментозное лечение, включающее рекомендации по образу жизни и
низкопуриновую диету.
УУР В, УДД 3
Симптоматическое лечение (купирование острого приступа артрита)
Рекомендовано обучить каждого пациента самостоятельному применению лекарственных препаратов при возникновении острого приступа подагры как можно раньше, в соответствии с данными врачом рекомендация с целью быстрого облегчения боли и купирования воспаления [82,147].
УУР С, УДД 5
Комментарии. Подагра проявляется быстро развивающимися, чрезвычайно болезненными, повторяющимися обострениями воспалительного процесса с тяжелым началом. Пациенты обычно обращаются за неотложной помощью, но они не всегда видят врача так быстро, как это необходимо. При этом следует избегать задержек в назначении соответствующих препаратов, обучая пациентов навыкам самостоятельного лечения при обострениях артрита, так как раннее назначение противовоспалительной терапии при приступах артрита (в первые сутки) приводит к лучшему клиническому результату. Например, показано, что колхицин наиболее эффективен, когда его вводили в течение первых 12 часов после обострения [154]. Стратегия лечения приступов подагры «таблетка в кармане» рекомендуется всем пациентам.
Рекомендовано объяснить каждому пациенту, что лечение подагры не ограничивается только лечением острого приступа артрита. Каждый пациент должен быть осведомлен о важности УСТ, которая является наиболее важным компонентом лечения подагры [82, 147].
УУР С, УДД 5
Комментарии. Подагра часто воспринимается как острое заболевание, так как разрешение приступов артрита приводит к полному исчезновению клинических симптомов болезни. Тем не менее приступы возникают в результате хронического отложения кристаллов МУН, поэтому сохраняется высокий риск рецидивов артрита, если сохраняются отложения кристаллов, чего можно избежать путем длительного приема уратснижающих препаратов. Таким образом, пациенты должны быть проинформированы о том, что отложение кристаллов МУН продолжается и лечения, направленного только на купирование обострений артрита, недостаточно [155, 156]. •
Рекомендовано выбирать конкретный лекарственный препарат для купирования острого приступа артрита, исходя из наличия сопутствующих заболеваний (ССЗ, ХБП, СД, язвенная болезнь, инфекции и т. д.), и учитывать лекарственные взаимодействия [82, 85, 147, 152].
УУР В, УДД 3
Комментарии. В силу распространенности у больных подагрой сопутствующих заболеваний, до 90% пациентов с подагрой имеют хотя бы одно абсолютное или относительное противопоказание к применению нестероидных противовоспалительных препаратов (НПВП) и глюкокортикоидов (ГК) и до 2/3 — к колхицину [88, 157].
Рекомендовано учитывать количество и тип пораженных суставов у каждого пациента с острым приступом подагры, так как это может повлиять на выбор метода лечения и препарата при лечении приступа [82, 158].
УУР C, УДД 5
Комментарии. Локальной терапии, например, внутрисуставным инъекциям ГК, следует отдавать предпочтение при моноартритах крупных суставов, тогда как системные методы более актуальны при обострениях артритов с вовлечением нескольких суставов или труднодоступных для внутрисуставных инъекций местах [88, 157].
Рекомендуется всем пациентам в качестве первой линии терапии острого артрита назначать колхицин, НПВП или ГК [71, 85, 146, 147, 159, 160-163].
УУР B, УДД 1
Комментарии. Согласно данным метаанализов и РКИ, НПВП, колхицин и ГК эффективны в лечении острого приступа подагры [158 - 172]. Достаточных доказательств для ранжирования их по эффективности нет. •
Колхицин рекомендуется начинать как можно раньше, в идеале в течение первых 12 часов, в низких дозах и следующем режиме дозирования: 1 мг в начале обострения, затем 0,5 мг через час и в последующие дни по 0,5 мг 2-3 раза в день в зависимости от тяжести артрита [82, 169, 172, 173].
УУР С, УДД 2
Комментарии. Эффективность колхицина при лечении острых приступов подагрического артрита была продемонстрирована в двух рандомизированных плацебо-контролируемых исследованиях. В исследовании AGREE сравнивались высокие и низкие дозы колхицина, назначенные в течение первых 12 часов от начала обострения артрита, при этом эффективность низких и высоких доз была сопоставимой и превышала таковую в плацебо, тогда как частота нежелательных явлений при применении низкой дозы была меньшей, чем при применении высокой [169]. Эффективность колхицина при приеме в дозе 0,5 мг 3 раза в сутки сопоставима с приемом напроксена в дозе 750 мг в сутки [174]. Эффективность короткого курса низких доз колхицина (1,5 мг в первый день и 1 мг во второй) у пациентов с острым артритом при болезни депонирования кристаллов пирофосфата кальция, другим микрокристаллическим артритом, характеризующейся схожем по механизму развития и тяжести приступов острого воспаления в суставах, не уступало приёму преднизолона в дозе 30 мг в сутки в течение 2-х дней [175].
В случае связанной с приемом колхицина диареи, которая
является первым признаком токсичности, рекомендуется уменьшить дозу либо
прекратить лечение, а также уменьшить дозу колхицина у пациентов с нарушением
функции почек (рекомендуемые дозы исходя из расчетной СКФ представлены в
Приложении А3-5) в случае одновременного назначения препаратов, влияющих на
метаболизм колхицина [176 - 179]
УУР В, УДД 1
Комментарии. Токсическое действие колхицина чаще проявляется
симптомами, имитирующими гастроэнтерит (диарея, тошнота, рвота) и являющимися
первыми признаками отравления колхицином, которое может привести к фатальным
последствиям, таким как панцитопения, энцефалопатия, миопатия, а также почечная,
печеночная или сердечная недостаточность [180 - 182]. Фармакокинетика колхицина
включает два основных фермента: P-гликопротеин, отвечающий за его клиренс через
пищеварительный тракт и почки, и CYP3A4, ответственный за метаболизм колхицина
в печени [182]. Несколько часто назначаемых ингибиторов P-гликопротеина/CYP3A4,
таких как циклоспорин• **, кларитромицин**, верапамил** или кетоконазол,
повышают уровень колхицина в плазме и вызывают у пациентов с повышенным риском
серьезные побочные эффекты [176, 177].
При сниженной функции печени принимать колхицин не рекомендуется [180, 183, 184].
УУР С, УДД 3
Комментарии. Поскольку известно, что колхицин метаболизируется в печени [182], пациентам с гепатоцеллюлярной недостаточностью применение препарата не рекомендуется, хотя соответствующих исследований не проводилось.
ГК (преднизолон• **, метилпреднизолон**) рекомендуется назначать в дозе от 30-35 мг в сутки (в пересчете на преднизолон**) на 3-5 дней с последующим постепенным снижением дозы до полной отмены в течение 10-14 дней, тогда как внутрисуставные инъекции ГК должны быть предпочтительнее для лечения моноартрита, если пораженный сустав легко доступен для подобной манипуляции [82, 161,163, 185]. УУР В, УДД 1
Комментарии. Имеющиеся результаты нескольких рандомизированных и открытых контролируемых исследований продемонстрировали сопоставимую с НПВП эффективность преднизолона** в отношении динамики симптомов артрита в дозах от 30 до 35 мг в сутки и локальных инъекций ГК [171,186].
Вне зависимости от выбранного метода лечения применение ГК не рекомендуется пациентам с неконтролируемым СД 2 и высокими значениями АД [71, 187, 188].
УУР С, УДД 5
Комментарии. /А-терапия, независимо от выбранного метода лечения, может приводить к нарушению кровообращения, подъему АД и гипергликемии [187].
НПВП (#нимесулид 100 мг 2 раза в сутки, эторикоксиб 120 мг в сутки, диклофенак** 75 мг 2 раза в сутки, #ибупрофен** 800 мг 3 раза в сутки, индометацин 50 мг 3-4 раза в сутки, кетопрофен** 100 мг 2 раза в сутки) для купирования острого приступа артрита рекомендуется назначать перорально в максимальной дозе, но необходимо избегать при ХБП 4-5 стадии или тяжелой степени ССЗ [146, 147, 189 - 196].
УУР В, УДД 1 для всех ЛП, за исключением нимесулида и ибупрофена, УДД 5 УРР С для ибупрофена и нимесулида.
Комментарии. Использование НПВП для лечения приступов подагры хорошо изучено и эффективность их доказана, однако назначению НПВП должен предшествовать тщательный скрининг ФР ССЗ и оценка почечной функции [146]. Несмотря на то, что длительность курса приема НПВП при остром приступе ограничена, как правило, несколькими днями, риск серьезных сердечно-сосудистых событий (включая инсульт) увеличивается уже в течение первой недели после лечения и дозозависим [197].
Назначение моноклональных антител к ИЛ-1 (канакинумаб**, #анакинра** 100 мг в сутки п/к) рекомендуется пациентам с наличием абсолютных противопоказаний и/или при неэффективности НПВП, колхицина и ГК, в том числе их комбинаций, для купирования острого приступа артрита как минимум в течении 3 дней в случае отсутствия противопоказаний к их назначению [71, 82, 100, 147, 150, 160, 198, 199]. УУР В, УДД 2
Комментарий. Эффективность канакинумаба** в виде однократной подкожной инъекции в дозе 150 мг при купировании приступа артрита при подагре превышает таковую у триамцинолона и колхицина, однако риск развития серьезных нежелательных явлений, в первую очередь инфекций, при применении канакинумаба** выше [100]. Эффективность анакинры** 100 мг 1 раз в день в виде подкожных инъекций не уступает таковой у колхицина, напроксена или преднизолона**, а также триамцинолона по данным РКИ и клинических исследований [198, 199], однако у препарата нет зарегистрированных показаний для применения при подагре, его можно назначать только off-label. по решению врачебной комиссии, после получения информированного согласия пациента. Решение о продолжительности лечения #анакинры** принимается лечащим врачом и зависит от эффективности и переносимости терапии. 5-дневный курс терапии #анакинрой** у пациентов с подагрой не увеличивает риск развития инфекционных осложнений и является достаточным для большинства пациентов [198]. Продолжающаяся инфекция является абсолютным противопоказанием к применению ингибиторов ИЛ-1, перед их назначением необходимо провести исследование крови для исключения лейкопении и нейтропении (исследование уровня лейкоцитов в крови; дифференцированный подсчет лейкоцитов (лейкоцитарная формула)).
3.1.2. Уратснижающая терапия
Рекомендовано объяснять каждому пациенту с подагрой, что обострения связаны с хроническим воздействием кристаллов МУН и что целью лечения является постоянное снижение уровня МК в сыворотке для полного растворения отложений кристаллов и исчезновения клинических проявлений болезни [82, 85, 147].
УУР С, УДД 5
Комментарий. Известно, что подагру вызывают только кристаллы МУН, которые активируют инфламмасомы, приводя к острым приступам артрита, а также накапливаются в виде тофусов, в том числе в костной ткани, приводя к эрозивному повреждению костей [200]. Пациентам необходимо знать, что избавление от этих кристаллов, которое возможно при снижении сывороточного уровня МК ниже точки насыщения, в конечном итоге приведет к полному исчезновению подагры, приступов артрита и рассасыванию тофусов [201].
Постоянная УСТ рекомендована всем пациентам с подагрой сразу после постановки диагноза [149, 202].
УУР В, УДД 2
Комментарии. Подагра может быть независимым ФР преждевременной общей и сердечно-сосудистой смерти [203]. Сердечно-сосудистые и почечные заболевания и ФР со временем накапливаются [204], что затрудняет позднее лечение подагры [88]. Кроме того, приступы подагрического артрита обычно вызывают мучительную боль, и пациенты максимально заинтересованы в том, чтобы избавиться от рисков рецидивов как можно раньше [78].
Для всех пациентов с подагрой настоятельно рекомендуется достижение и поддержание целевого уровня МК < 360 мкмоль/л (< 6 мг/дл) [71,147, 152].
УУР В, УДД 3
Комментарии. Поддержание сывороточного уровня МК < 360 мкмоль/л (< 6 мг/дл) (соответствует минимальному значению, при котором в организме человека происходит кристаллизация МК [205]) на протяжении длительного времени отождествляется с постепенным снижением частоты и в итоге полным прекращением приступов подагрического артрита и растворением подкожных тофусов [206, 207]. •
Рекомендуется у пациентов с тофусной подагрой и хроническим артритом поддержание сывороточного уровня МК < 300 мкмоль/л [71, 82, 152].
УУР В, УДД 3
Комментарии. Растворение кристаллов МУН — медленный процесс. Последние исследования с использованием ДЭКТ показали, что при уровне МК сыворотки < 360 мкмоль/л растворение кристаллов МУН не всегда бывает полным даже после 2 лет лечения, если объем отложений кристаллов значителен [208]. Учитывая взаимосвязь между нагрузкой кристаллами МУН и вероятностью риска обострения подагры [209] и тот факт, что взаимосвязь между снижением уровня МК сыворотки, уменьшением частоты приступов артрита и редукцией размеров тофусов достигается при сывороточном уровне МК <300 мкмоль/л [74, 210], этот уровень следует принимать за целевой у пациентов с хроническим артритом и наличием тофусов. Лица, которые достигли и поддерживали концентрацию МК в сыворотке крови менее < 360 ммоль/л, имели обострение подагры между 12 и 24 месяцами наблюдения в 2,4 реже, чем не ответившие на лечение (МК сыворотки > 360 мкмоль/л) (27% пациентов и 64% пациентов соответственно, p < 0,0001), среднее количество обострений на человека в месяц также было значительно ниже у лиц с уровнем МК < 360 ммоль/л (р < 0,0001) [211].
Не рекомендуется длительное (в течение нескольких лет) поддержание сывороточного уровня МК < 180 мкмоль/л [82].
УУР В, УДД 3
Комментарии. При очень низком уровне МК в сыворотке крови (<180 мкмоль/л) увеличивается риск некоторых нейродегенеративных заболеваний (болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз) [212 - 216].
Лечение аллопуринолом• ** в качестве препарата первой линии рекомендуется всем пациентам с подагрой с нормальной функцией почек [84, 148, 150, 217, 218].
УУР А, УДД 1
Комментарии. Длительный опыт применения, доказанная эффективность при правильном титровании дозы аллопуринола** (итоговое назначение дозировки >300 мг в сутки, но не выше максимально допустимой — 900 мг в сутки) позволяют рассматривать препарат в качестве средства первой линии терапии подагры [217 - 220]. Вероятность достижения целевого уровня МК в сыворотки крови при титровании доз аллопуринола и фебуксостата до максимально допустимых, как и частота НЛР, сопоставимы [221]. Кроме того, медико-экономические исследования по применению данных ингибиторов синтеза МК (ингибиторов КСО (аллопуринол** и фебуксостат)) показали, что стратегия постепенного увеличения дозы с аллопуринолом** в качестве терапии первой линии экономически целесообразна [222]. Однако при ХБП эффективность аллопуринола** в низких дозах уступает таковой у фебуксостата [220], применение низких доз препарата часто не приводит к достижению целевого уровня МК сыворотки [223]. Наличие ХБП увеличивает риск тяжелых кожных реакций, свойственных аллопуринолу** [224], поэтому применять аллопуринол** у пациентов с ХБП нужно с осторожностью.
Рекомендовано начинать терапию аллопуринолом** в стартовой дозе 100 мг в сутки с постепенным титрованием дозы по 100 мг каждые 2-4 недели до достижения целевого уровня МК сыворотки [83, 225, 226].
УУР В, УДД 3
Комментарии. Аллопуринол• ** следует начинать с низкой дозы (100 мг/сут), чтобы уменьшить риск развития острых приступов подагры, так как он увеличивается, если происходит резкое снижение сывороточного уровня МК [227], и а также, чтобы снизить риск серьезных кожных реакций, вероятность которых многократно возрастает, если стартовые дозы выше [228]. Наиболее часто используемая доза аллопуринола** (300 мг/сут) не позволяет достичь целевого уровня МК сыворотки у 30-50% пациентов с нормальной функцией почек, поэтому в этом случае целесообразно продолжить эскалацию дозы препарата до достижения целевого уровня МК (максимально допустимая доза аллопуринола** — 900 мг/сут), что позволяет достичь целевого уровня МК в 75-92% случаев) [221, 226, 228]. Последовательное титрование дозы аллопуринола по 50 мг каждые 2-4 недели у пациентов со сниженной СКФ позволяет достигать целевых значений уровней МК при использовании меньших доз чем у пациентов с нормальной функцией почек [152, 229].
Пациентам с неэффективностью аллопуринола** (недостижение целевого уровня МК при применении максимальных доз) в качестве альтернативы рекомендуется назначение фебуксостата в дозе 80-120 мг в сутки или #40 мг/сутки [82, 147,149, 230 - 235].
УУР A, УДД 1 для режимов дозирования 80-120 мг/сутки, УДД А УУД 2 для режима 40 мг/сутки
Комментарии. В случае неэффективности или непереносимости аллопуринола** назначение фебуксостата позволяет достичь целевого уровня МК сыворотки в более чем половине случаев [236 - 239]. Согласно последним рекомендациям АКР и Французского общества ревматологов по лечению начальная доза фебуксостата составляет 40 мг/сутки [147, 149]. Доза 40 мг/сутки фебуксостата эквивалентна по эффективности в отношении снижения уровня МК 300 мг/сутки аллопуринола и в 3050% достаточна для достижения целевого уровня МК [231, 233, 240]. Таким образом в ряде ситуаций, особенно у пациентов с ХБП, для которых средняя эффективная доза фебуксостата может быть меньшей [233], возможно использовать в качестве стартовой дозу 40 мг/сутки.
У пациентов со сниженной функцией почек (расчетная СКФ <60 мл/мин/1,73 м2, и особенно СКФ <30 мл/мин/1,73 м2) наряду с аллопуринолом препаратом выбора является фебуксостат [149, 150, 241].
УУР A, УДД 1
Комментарии. Фебуксостат является действенной альтернативой аллопуринолу• ** у пациентов с ХБП, поскольку он, в отличие от аллопуринола**, только частично выводится почками. Прием фебуксостата показал свою эффективность при сохранении профиля безопасности даже в случае снижения расчетной СКФ <60 мл/мин/1,73 м2, что подтверждают данные нескольких исследований, где использовали стандартные дозы препарата (40(80)-120 мг/сут) [230, 242 - 245].
При титровании дозы аллопуринола** и фебуксостата у всех пациентов с подагрой рекомендовано контролировать уровень МК, активность АСТ и АЛТ, а также уровень креатинина (исследование уровня мочевой кислоты в крови; определение активности аспартатаминотрансферазы в крови, определение активности аланинаминотрансферазы в крови, исследование уровня креатинина в крови) в крови через 14-28 дней от назначения/модификации УСТ [82, 220, 246, 247].
УУР C, УДД 5
Комментарии. Оценка эффективности УСТ, как правило, проводится через 14-28 дней. Повышение уровня трансаминаз - НЯ при применении аллопуринола** и фебуксостата развиваются наиболее часто, при этом вероятность развития НР может зависеть от дозы указанных препаратов, хотя эта зависимость не линейна [220, 230, 237, 247, 248].
По достижении целевого уровня МК рекомендуется продолжение УСТ на неопределенный срок [147].
УУР C, УДД 5
Комментарии. В случае многолетней клинической ремиссии (отсутствии приступов подагрического артрита при стойко низком сывороточном уровне МК) прекращение УСТ не приводило к обострению артрита при 5-летнем наблюдении только у 13% пациентов (27 из 211) даже при незначительной ГУ (< 420 мкмоль/л (< 7 мг/дл)) [249]. Кроме того, чем выше сывороточный уровень МК после отмены терапии, тем быстрее и чаще возникают новые приступы артрита [219].
Рекомендуется регулярный, не реже 1 раза в 6 месяцев, контроль уровня МК в крови — исследование уровня мочевой кислоты в крови — при достижении целевого уровня МК и подобранной УСТ [147, 250].
УУР С, УДД 5
Комментарии. Даже в случае достижения целевого сывороточного уровня МК с течением времени он может меняться, в том числе при стабильной дозе ингибиторов синтеза МК (ингибиторов КСО (аллопуринол• ** и фебуксостат)). Это предопределяет необходимость постоянного мониторирования уровня МК сыворотки [250].
Пациентам с наличием показаний к приему антигипертензивных средств рекомендуется рассмотреть возможность назначения лозартана**, обладающего умеренным уратснижающим эффектом [82, 147, 251].
УУР C, УДД 3
Комментарии. Для пациентов с подагрой и высоким АД лозартан следует рассматривать как средство первой линии гипотензивной терапии, учитывая его доказанный уратснижающий эффект. Однако, так как снижение сывороточного уровня МК при применении препарата незначительное, его применение не может быть альтернативой аллопуринолу** и фебуксостату [251 - 253].
Пациентам с наличием гипертриглицеридемии рекомендуется рассмотреть возможность назначение фенофибрата**, обладающего уратснижающим эффектом [82].
УУР C, УДД 1
Комментарии. Уратснижающий эффект фенофибрата, связанный с выраженным ингибированием уратных транспортеров в почках, позволяет существенно снизить сывороточный уровень МК, что подтверждается данными метаанализа [254], а в некоторых случаях — достичь целевого уровня МК у пациентов с подагрой [255]. Эти результаты позволяют рассматривать фенофибрат** в качестве препарата для пациентов с гипертриглицеридемией.
Пациентам с подагрой при наличии СД2 рекомендуется рассмотреть возможность назначения в качестве сахароснижающего ингибиторов натрийзависимого переносчика глюкозы 2-го типа (НГЛТ-2), обладающих умеренным уратснижающим эффектом [256 - 261].
УУР А, УДД 2
Комментарии. Медикаментозное ингибирование натрий-глюкозного котранспортера 2 типа (НГЛТ-2) в результате применения ингибиторов НГЛТ-2 приводит к избыточному содержанию глюкозы в первичной моче, что способствует избыточной активности транспортера GLUT-9 для снижения глюкозурии и одновременному усилению выведения МК в обмен на глюкозу [262]. Урикозурический эффект является класс-специфическим, он подтвержден результатами метаанализов [256 - 260].
Пациентам с подагрой, принимающим петлевые или тиазидные диуретики, рекомендуется рассмотреть возможность отмены указанных препаратов [40, 56, 81, 147, 149, 263, 264].
УУР В, УДД 3
Комментарии. Учитывая, что петлевые и и тиазидные диуретики приводят к ГУ и возрастанию риска развития подагры [56], при наличии возможности они должны быть отменены или заменены на другие антигипертензивные средства. Тем не менее, при приеме уратснижающих препаратов возможно достижение целевого уровня МК сыворотки при параллельном применении диуретиков (в 68% случаев при приеме аллопуринола** и 81% — фебуксостата) [265].
Прекращение приема низких доз ацетилсалициловой кислоты** у пациентов с подагрой не рекомендуется [147].
УУР С, УДД 5
Комментарии. Так как негативное влияние низких доз ацетилсалициловой кислоты** на уровень МК сыворотки незначительное, а по данным недавнего РКИ — даже отсутствует [266], отмена препарата при наличии показаний к его применению нецелесообразна.
3.1.3. Профилактика приступов артрита
Всем пациентам с подагрой рекомендуется профилактический прием низких доз колхицина (0,5-1,0 мг/сут) или НПВП или ГК в первые 6 месяцев применения уратснижающих препаратов [71, 81, 149].
УУР С, УДД 5
Комментарии. Начало УСТ обычно связано с повышенным риском обострений подагрического артрита в сравнении с плацебо на протяжении первых 6 месяцев после достижения целевого уровня МК сыворотки [207]. Низкие дозы колхицина (0,51,0 мг в сутки) [267, 268], НПВП (например, #напроксен-250 мг 2 раза в сутки, мелоксикам 7,5 мг в сутки) [269, 270] и ГК (преднизолон** 7,5 мг в сутки) [267] могут быть эффективным методом снижения частоты приступов артрита в первые 6 месяцев терапии у пациентов, принимающих аллопуринол** и фебуксостат [207, 271]. Есть данные об экономической целесообразности применения низких доз колхицина (0,5 мг 2 раза в сутки) на протяжении 6 месяцев с целью профилактики острых приступов подагрического артрита при инициации УСТ (титрование дозы аллопуринола• ** от целевого уровня МК сыворотки (360 мкмоль/л) [250, 267]. Выбор конкретного препарата осуществляется индивидуально, исходя из наличия противопоказаний к применению каждого препарата. Дополнительным фактором, позволяющим рассматривать колхицин в качестве приоритетного препарата для профилактики приступов артрита - благоприятное влияние длительного применения низких доз препарата (0,5-1,0 мг/сут) на риск сердечно-сосудистых событий как у пациентов с подагрой [272, 273], так и в общей популяции [274 - 278]. Кроме того, противопоказания к приёму колхицина у пациентов с подагрой встречаются реже, чем противопоказания к приёму НПВП и ГК [157, 279].
При назначении НПВП с целью профилактики приступов артрита рекомендуется при низком риске развития осложнений со стороны желудочно-кишечного тракта (ЖКТ) использовать неселективные ингибиторы циклооксигеназы-2 (ЦОГ-2) (например, напроксен; диклофенак**, амтолметин гуацил, ацеклофенак и пр.), при наличии риска осложнений со стороны ЖКТ — селективные ингибиторы ЦОГ-2 (мелоксикам) с параллельным приемом ингибиторов протонного насоса (омепразол**, пантопразол, лансопразол, рабепразол, эзомепразол** и др.) [71, 82, 280].
УУР С, УДД 5
Комментарий. Сравнительных исследований по длительному применению различных НПВП для профилактики приступов артрита между собой не проводилось. Экспертное мнение основано на анализе основных принципов длительного применения НПВП, изложенных в национальных и международных консенсусах [279]. Практический опыт длительного применения НПВП пациентами с подагрой с целью профилактики приступов артрита при инициации УСТ показал его высокую эффективность [271].
Не рекомендуется назначать НПВП пациентам с подагрой с высоким и очень высоким риском кардиоваскулярных осложнений [280].
УУР С, УДД 5
Комментарий. Высокий и очень высокий сердечно-сосудистый риск при подагре выявляется очень часто (у 17-29% пациентов, по разным оценочным шкалам) [281], применение НПВП у этой категории пациентов должно соответствовать существующим рекомендациям по применению НПВП.
При назначении колхицина с целью профилактики приступов артрита у пациентов с подагрой рекомендуется оценивать риски развития НЛР: не реже 1 раза в 2-3 месяца проводить клинический осмотр, анализ крови биохимический общетерапевтический, общий (клинический анализ) крови развернутый, исследование уровня/активности изоферментов креатинкиназы в крови [82, 147, 282].
УУР С, УДД 5
Комментарии. Среди редких нежелательных реакций, связанных с приемом колхицина, есть такие тяжелые, как миопатия [283], нейропатия [284], цитопения (тромбо-, лейко-, панцитопения, апластическая анемия) [285], что предполагает необходимость динамического наблюдения в случае длительного приема препарата.
При назначении с целью профилактики приступов артрита ГК в низких дозах (например, преднизолон** 7,5 мг в сутки) рекомендуется оценивать риски развития нежелательных реакций (эрозивно-язвенные поражения ЖКТ, заболевания сердечнососудистой системы, нарушения углеводного обмена, остеопороз и др.) [268, 286 - 288].
УУР С, УДД 4
Комментарии. Данная рекомендация основана на анализе рисков, связанных с длительным применением ГК, однако имеющихся исследований по длительному применению ГК у пациентов с подагрой недостаточно для оценки вероятности реализации этих рисков.
3.1.4. Рекомендации насчет образа жизни
Всем пациентам с подагрой рекомендуется ограничение употребления алкоголя [46, 29, 290].
УУР В, УДД 2
Комментарии. Прием любого алкоголя, особенно пива и крепких спиртных напитков, приводит к увеличению сывороточного уровня МК и дозозависимо увеличивает риск развития подагры, а также увеличивает риск приступов артрита у пациентов с подагрой как при регулярном приеме, так и при потреблении непосредственно перед приступом артрита. Поэтому прием алкоголя у пациентов с подагрой целесообразно ограничить [291, 292].
Всем пациентам с подагрой рекомендуется ограничение употребления мяса красных сортов, рыбы и морепродуктов [46, 54, 71, 82, 293, 294].
УУР A, УДД 2
Комментарии. Недавнее потребление отдельных продуктов питания, прежде всего мяса красных сортов, рыбы и морепродуктов, увеличивает сывороточный уровень МК и вероятность острых приступов подагрического артрита [291 - 294]. Вероятность острого приступа артрита у пациентов с подагрой при потреблении богатых пуринами продуктов животного происхождения увеличивает риск приступов артрита у пациентов с подагрой, по данным одного их наиболее крупных исследований, почти в 5 раз [292].
Всем пациентам с подагрой рекомендуется ограничение употребления фруктозосодержащих напитков [45, 46, 71, 82, 294].
УУР А, УДД 2
Комментарии. По данным метаанализа, избыточное потребление фруктозы превышает риски развития ГУ в сравнении с потреблением мяса и морепродуктов [293]. Потребление фруктозы в объеме 1 г/кг массы тела у пациентов с подагрой увеличивает сывороточный уровень МК сыворотки на 60-120 мкмоль/л [295].
Снижение веса рекомендуется для всех пациентов с подагрой и ожирением или избыточной массой [71, 82, 296 - 298].
УУР В, УУР 3
Комментарии. Снижение веса, независимо от того, достигнуто оно в результате диеты или физической активности, связано с нормализацией уровня МК [296, 298]. Детальный анализ 10 ключевых исследований показал, что потеря веса у пациентов с избыточной массой тела и подагрой при среднесрочном/долгосрочном наблюдении приводит к снижению сывороточного уровня МК и частоты приступов артрита [296]. •
Пациентам с подагрой рекомендуется дозированная физическая нагрузка [82, 299 - 301].
УУР С, УУР 4
Комментарии. Схемы физической нагрузки при ГУ не разработаны и отсутствуют данные РКИ. По результатам единичных работ показано, что при физической активности > 150 мин/нед у пациентов с ГУ достоверно снижается риск смерти в сравнении в теми, кто имел низкую физическую активность [299]. Регулярная,дозированная физическая нагрузка ассоциируется с более низким уровнем МК [296, 301].
3.2. Хирургическое лечение
Хирургическое лечение подагры, заключающееся в удалении поверхностно расположенных инородных тел или удаление инородного тела с рассечением мягких тканей, содержащих кристаллы МУН (тофусов), рекомендовано в случае компрессии тофусами нервных стволов с развитием неврологической симптоматики (при поражении позвоночника, карпального канала и т. д.) [152, 153, 302 - 304].
УУР В, УДД 3
Комментарии. Сравнительных исследований по оперативному лечению подагры не проводилось, единичные описания клинических случаев демонстрируют эффективность хирургической декомпрессии нервных стволов путем удаления тофусных масс [305, 306]. В большинстве случаев к хирургическому лечению подагры прибегают, когда пациенты не получают УСТ, и она не рассматривается как действенный метод лечения заболевания (способ уменьшения количества уратов в организме) [302].
Эндопротезирование или артродез суставов рекомендуется при наличии выраженных структурных изменений, сопровождающихся стойкой болью и нарушениями функции суставов в случаях неэффективности УСТ [100, 307, 308]. УУР С, УДД 4
Комментарии. При отсутствии адекватной терапии подагры велик риск поражения костной ткани, а потребность в эндопротезировании крупных суставов выше популяционной [307].
Услуги по НМУ:
Эндопротезирование сустава;
Эндопротезирование ортопедическое тазобедренного сустава;
Эндопротезирование ортопедическое тазобедренного сустава (резекция проксимального отдела бедренной кости);
Эндопротезирование сустава (реэндопротезирование);
Эндопротезирование коленного сустава тотальное;
Эндопротезирование голеностопного сустава;
Эндопротезирование плюснефалангового сустава;
Эндопротезирование межфалангового сустава;
Артродез позвоночника;
Артродез стопы и голеностопного сустава;
Артродез других суставов.
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
Рекомендуется повышать информированность и уровень образования пациентов с подагрой, том числе в рамках школ для больных с заболеваниями суставов и позвоночника [147, 227, 309].
УУР В, УДД 2
Комментарии. Образовательные программы, основная задача которых — объяснение пациентам цели терапии подагры (полный контроль над заболеванием, который возможен только при поддержании целевого уровня МК сыворотки крови), позволяют добиться лучшей приверженности к медикаментозному лечению и лучшим отдаленным результатам терапии [207, 210].
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Медикаментозная профилактика развития ГУ, острой уратной нефоропатии, синдрома лизиса опухоли, вторичной подагры (назначение #аллопуринола• ** 200-300 мг в сутки или фебуксостата) рекомендуется пациентам, получающим химиотерапию по поводу злокачественных новообразований, прежде всего пациентам с лимфопролиферативными заболеваниями с целью профилактики гиперурикемии и развития синдрома лизиса опухоли [71, 247, 310 - 312].
УУР C, УДД 2
Комментарии. Пациенты с высоким риском синдрома лизиса опухоли, характеризующегося быстрым цитолизом, что приводит к развитию в том числе ГУ и острой почечной недостаточности [313], включают пациентов с большой опухолевой нагрузкой, высокой скоростью разрастания опухолей, высокой чувствительностью к химиотерапии или биотерапии, а также с гематологическими злокачественными новообразованиями, в частности с острыми лейкозами или лимфомами высокой степени [314, 315].Частота иногда необратимой уратной нефропатии достигает 30% [316]. По данным метаанализа и РКИ, профилактика синдрома лизиса опухоли при назначении аллопуринола** и фебуксостата одинаково эффективна при схожем профиле безопасности [311, 312].
6. Организация оказания медицинской помощи
Лечение пациентов с подагрой рекомендуется проводить врачами-ревматологами (в виде исключения — врачами-терапевтами и врачами общей практики (семейными врачами), но при консультативной и организационной поддержке врача-ревматолога) с привлечением других специалистов (врача-клинического фармаколога, врача- диетолога и др.) и основываться на тесном взаимодействии врача и пациента [317, 318].
УУР С, УДД 4
Комментарии. Результаты лечения, потребность в экстренной медицинской помощи у пациентов с подагрой, находящихся под наблюдением у ревматологов, лучше, чем у тех, кто находится под наблюдением врачей общей практики и терапевтов [319]. Мультидисциплинарный подход к ведению пациентов с подагрой позволяет снизить негативное влияние коморбидной патологии на уровень урикемии, клинические проявления заболевания, а также улучшить эффективность фармакотерапии и прогноз.
6.1. Показания для направления к врачу-ревматологу
Рекомендуется пациента с клиническим подозрением на подагру (наличием недифференцированного артрита) направлять на прием (осмотр, консультацию) врача-ревматолога для уточнения диагноза и назначения терапии, особенно при наличии сопутствующей патологии [71, 95, 156, 320 - 324].
УУР С, УДД 4
Комментарии. По данным ряда популяционных и когортных исследований, как диагностика, так и лечение подагры сопряжены с огромным количеством ошибок, допускаемых врачами первичного звена и предопределяющих большое и неснижающееся число случаев тяжелой тофусной подагры, [321 - 324].
3.2. Показания к госпитализации в специализированное отделение по профилю «Ревматология» или в терапевтическое отделение
Невозможность постановки диагноза на амбулаторном этапе/проведение дифференциальной диагностики и подбор терапии.
Хронический подагрический артрит с наличием сопутствующих заболеваний, включая ССЗ, обменные нарушения, заболевания почек.
Решение вопроса о назначении и проведении терапии ГИБП (ингибиторами ИЛ) и инициация данных методов терапии.
6.3. Критерии выписки из стационара
Отсутствие припухших суставов или уменьшение их числа не менее чем на 50% при олиго- или полиартрите.
Отсутствие боли в суставах или уменьшение её интенсивности на 50% и более относительно исходной по ВАШ (улучшение как минимум одного показателя из перечисленных является обязательным) (Приложение Г2).
6.4. Постановка диагноза
Для постановки диагноза подагры всем пациентам с наличием хотя бы одного эпизода отечности, боли или повышенной чувствительности в периферическом суставе или бурсе разработаны классификационные критерии American College of Rheumatology/ European League Against Rheumatism (ACR/EULAR) (Приложение Г1), которые следует использовать при включении пациента в клинические исследования и для постановки диагноза в клинической практике [62, 65].
Диагноз подагры устанавливается либо при визуальном обнаружении кристаллов МУН в СЖ или содержимом тофуса, либо при наличии совокупности клинических, лабораторных и инструментальных признаков заболевания, рассчитываемых в баллах. Согласно критериям, если баллов 8 и более, заболевание может быть классифицировано как подагра.
Принципы формулировки диагноза при подагре
В формулировке диагноза необходимо указать:
Течение заболевания:
хроническое — при наличии у пациента хронического артрита;
интермиттирующее — при рецидивах острых приступов артрита.
Характеристика артрита:
межприступный период;
острый артрит;
хронический артрит.
Наличие тофусов:
тофусная форма — наличие тофусов;
бестофусная форма — отсутствие тофусов.
Примеры диагноза:
Подагра, хроническое течение, хронический артрит, тофусная форма.
Подагра, хроническое течение, хронический артрит, бестофусная форма.
Подагра, интермиттирующее течение, межприступный период, тофусная форма.
Подагра, интермиттирующее течение, межприступный период, бестофусная форма.
Подагра, интермиттирующее течение, острый артрит, тофусная форма.
Подагра, интермиттирующее течение, острый артрит, бестофусная форма.
7. Дополнительная информация (в том числе факторы, влияющие на течение и исход заболевания)
7.1. Коморбидность
Характер сопутствующих (коморбидных) заболеваний имеет важнейшее значение для выбора тактики лечения с точки зрения как эффективности, так и безопасности терапии
Перед применением ингибиторов ИЛ-1 рекомендовано провести обследование всех пациентов с подагрой для исключения активной или латентной туберкулезной инфекции, включая сбор анамнеза, проведение тестов (внутрикожная проба с туберкулезным аллергеном, очаговая проба с туберкулином, исследование уровня интерферона-гамма на антигены Mycobacterium tuberculosis complex в крови) и рентгенографии легких [110 - 113].
УУР В, УДД 1
При выявлении туберкулезной инфекции лечение ингибиторами ИЛ-1 начинать или продолжать не рекомендовано [325].
УУР А, УДД 1
Комментарии. Хотя случаи выявления туберкулеза при применении ингибиторов ИЛ-1 единичные, вероятность развития инфекции дыхательных путей у пациентов, получающих ингибиторы ИЛ выше, чем у тех, кто получает плацебо [326].
7.2. Вакцинация
Рекомендуется проводить плановую вакцинацию всем пациентам с подагрой, так как потенциальная польза вакцинации превышает риски [327].
УУР С, УДД 3
Комментарии. Алюминиевые и неалюминиевые адъюванты, содержащиеся во многих других вакцинах для взрослых (вакцинах для профилактики столбняка, вакцинах для профилактики дифтерии, вакцинах для профилактики коклюша, вакцинах для профилактики пневмококковой инфекции, вакцинах для профилактики вирусных гепатитов (гепатита В),, вакцинах для профилактики ветряной оспы) способствуя выработке ИЛ-1, могут служить триггерными факторами развития острого приступа подагрического артрита, однако это не может быть причиной отказа от вакцинации, так как её преимущества как для индивидуального, так и для общественного здоровья огромны [328].
7.3. Беременность
Беременным женщинам с подагрой не рекомендован прием уратснижающих препаратов (аллопуринол**, фебуксостат) [114, 115, 117, 329, 330].
УУР C, УДД 5
Комментарии. Хотя, как предполагается, высокий уровень МК в сыворотке может ассоциироваться с преэклампсией [329, 331], и вероятность приступов артрита во время беременности в отсутствии контроля за сывороточным уровнем МК сохраняется, потенциальный риск для плода, связанный с применением аллопуринола и фебуксостата у беременных, не может оправдывать их использование. Хотя надлежащих исследований препаратов не было, а описанные случаи тератогенного действия аллопуринола имеют низкую причинно-следственную связь [115, 116, 332].
Критерии оценки качества медицинской помощи
Список литературы
Sackett DL, Rosenberg WM, Gray JA, et al. Evidence based medicine: what it is and what it isn't. BMJ. 1996;312(7023):71-72. doi:10.1136/bmj.312.7023.71.
Федеральный закон от 21.11.2011 № 323-ФЗ (ред. от 03.04.2017) «Об основах охраны здоровья граждан в Российской Федерации».
Эпидемиологический словарь, 4-е издание. Под ред. Джона М. Ласта для Международной эпидемиологической ассоциации. М., 2009. 316 с.
Федеральное агентство по техническому регулированию и метрологии. Национальный стандарт Российской Федерации. ГОСТР 52379-2005. Надлежащая клиническая практика. Москва, 2005.
Федеральный закон от 12.04.2010 № 61-ФЗ (ред. от 03.07.2016) «Об обращении лекарственных средств».
Малая медицинская энциклопедия. М.: Медицинская энциклопедия, 1991—96 гг.
Андреева НС, Реброва ОЮ, Зорин НА и др. Системы оценки достоверности научных доказательств и убедительности рекомендаций: сравнительная характеристика и перспективы унификации. Медицинские технологии. Оценка и выбор. 2012;4(10):10— 24.
Насонов ЕЛ, Елисеев МС. Роль интерлейкина 1 в развитии заболеваний человека. Научно-практическая ревматология. 2016;54(1):60-77. doi: 10.14412/1995-4484-2016- 60-77.
Martillo MA, Nazzal L, Crittenden DB. The crystallization of monosodium urate. Curr Rheumatol Rep. 2014;16(2):400. doi:10.1007/s11926-013-0400-9.
Loeb JN. The influence of temperature on the solubility of monosodium urate. Arthritis Rheum. 1972;15(2):189-192. doi:10.1002/art.1780150209.
Dalbeth N, Phipps-Green A, Frampton C, et al. Relationship between serum urate concentration and clinically evident incident gout: an individual participant data analysis. Ann Rheum Dis. 2018;77(7):1048-1052.
Dalbeth N, House ME, Aati O, et al. Urate crystal deposition in asymptomatic hyperuricaemia and symptomatic gout: a dual energy CT study. Ann Rheum Dis. 2015;74(5):908-911. doi:10.1136/annrheumdis-2014-206397.
Campion EW, Glynn RJ, DeLabry LO. Asymptomatic hyperuricemia. Risks and consequences in the Normative Aging Study. Am J Med. 1987;82(3):421-426. doi:10.1016/0002-9343(87)90441 -4.
Chen-Xu M, Yokose C, Rai SK, et al. Contemporary Prevalence of Gout and
Hyperuricemia in the United States and Decadal Trends: The National Health and Nutrition Examination Survey, 2007-2016. Arthritis Rheumatol. 2019;71(6):991-999.
Sumino H, Ichikawa S, Kanda T, et al. Reduction of serum uric acid by hormone replacement therapy in postmenopausal women with hyperuricaemia. Lancet. 1999;354(9179):650. doi:10.1016/S0140-6736(99)92381-4.
Boocock J, Leask M, Okada Y, et al. Genomic dissection of 43 serum urate-associated loci provides multiple insights into molecular mechanisms of urate control. Hum Mol Genet. 2020;29(6):923 -943. doi:10.1093/hmg/ddaa013.
Tin A, Marten J, Halperin Kuhns VL, et al. Target genes, variants, tissues and transcriptional pathways influencing human serum urate levels. Nat Genet. 2019;51(10):1459-1474. doi:10.1038/s41588-019-0504-x.
Choi HK, Curhan G. Soft. Beer, liquor, and wine consumption and serum uric acid level: the Third National Health and Nutrition Examination Survey. Arthritis Rheum. 2004;51(6):1023-1029. doi:10.1002/art.20821.
Choi HK, Atkinson K, Karlson EW, et al. Purine-rich foods, dairy and protein intake, and the risk of gout in men. N Engl J Med. 2004;350(11):1093-1103. doi:10.1056/NEJMoa035700.
Choi HK, Willett W, Curhan G. Fructose-rich beverages and risk of gout in women. JAMA. 2010;304(20):2270-2278. doi:10.1001/j ama.2010.1638.
McAdams DeMarco MA, Maynard JW, Baer AN, et al. Diuretic use, increased serum urate levels, and risk of incident gout in a population-based study of adults with hypertension: the Atherosclerosis Risk in Communities cohort study. Arthritis Rheum. 2012;64(1):121-129. doi:10.1002/art.33315.
Mikuls TR, Farrar JT, Bilker WB, et al. Gout epidemiology: results from the UK General Practice Research Database, 1990-1999. Ann Rheum Dis. 2005;64(2):267-272. doi:10.1136/ard.2004.024091.
Cohen SD, Kimmel PL, Neff R, et al. Association of incident gout and mortality in dialysis patients. J Am Soc Nephrol. 2008;19(11):2204-2210. doi:10.1681/ASN.2007111256.
Galozzi P, Bindoli S, Doria A, et al. Autoinflammatory Features in Gouty Arthritis. J Clin Med. 2021;10(9):1880. Published 2021 Apr 26. doi:10.3390/jcm10091880.
Choi HK, Mount DB, Reginato AM; American College of Physicians; American Physiological Society. Pathogenesis of gout. Ann Intern Med. 2005;143(7):499-516. doi:10.7326/0003-4819-143-7-200510040-00009.
Dehlin M, Jacobsson L, Roddy E. Global epidemiology of gout: prevalence, incidence, treatment patterns and risk factors. Nat Rev Rheumatol. 2020;16(7):380-390. doi:10.1038/s41584-020-0441-1.
Safiri S, Kolahi AA, Cross M, et al. Prevalence, Incidence, and Years Lived With Disability Due to Gout and Its Attributable Risk Factors for 195 Countries and Territories 1990-2017: A Systematic Analysis of the Global Burden of Disease Study 2017. Arthritis Rheumatol. 2020;72(11):1916-1927. doi:10.1002/art.41404.
GBD 2017
DALYs and HALE Collaborators. Global, regional, and national disability- adjusted
life-years (DALYs) for 359 diseases and injuries and healthy life expectancy
(HALE) for 195 countries and territories, 1990-2017: a systematic analysis for
the Global Burden of Disease Study 2017 [published correction appears in
Lancet. 2019 Jun 22;393(10190):e44]. Lancet. 2018;392(10159):1859-1922.
Choi HK, Curhan G. Independent impact of gout on mortality and risk for coronary heart disease. Circulation. 2007;116(8):894-900. doi:10.1161/CIRCULATIONAHA.107.703389.
Vargas-Santos AB, Neogi T, da Rocha Castelar-Pinheiro G, et al. Cause-Specific Mortality in Gout: Novel Findings of Elevated Risk of Non-Cardiovascular-Related Deaths. Arthritis Rheumatol. 2019;71(11):1935-1942. doi:10.1002/art.41008.
Fisher MC, Rai SK, Lu N, et al. The unclosing premature mortality gap in gout: a general population-based study. Ann Rheum Dis. 2017;76(7):1289-1294. doi:10.1136/annrheumdis- 2016-210588.
Danve A, Neogi T. Rising Global Burden of Gout: Time to Act. Arthritis Rheumatol. 2020;72(11):1786-1788. doi:10.1002/art.41453.
Черёмушкина ЕВ, Елисеев МС. Гиперурикемия и подагра: влияние на костный метаболизм и суставной хрящ (обзор литературы). Ожирение и метаболизм. 2022;19(3):348-357. doi:10.14341/omet12894.
Zhang W, Doherty M, Pascual E, et al. EULAR evidence based recommendations for gout. Part I: Diagnosis. Report of a task force of the Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis. 2006;65(10):1301-1311. doi:10.1136/ard.2006.055251.
Sivera F, Andres M, Carmona L, et al. Multinational evidence-based recommendations for the diagnosis and management of gout: integrating systematic literature review and expert opinion of a broad panel of rheumatologists in the 3e initiative. Ann Rheum Dis. 2014;73(2):328-335. doi:10.1136/annrheumdis-2013-203325.
Kuo CF, Grainge MJ, Zhang W, Doherty M. Global epidemiology of gout: prevalence, incidence and risk factors. Nat Rev Rheumatol. 2015;11(11):649-662. doi:10.1038/nrrheum.2015.91.
Liote F, Lancrenon S, Lanz S, et al. GOSPEL: prospective survey of gout in France. Part I: design and patient characteristics (n = 1003). Joint Bone Spine. 2012;79(5):464-470. doi: 10.1016/j .jbspin.2011.12.006.
Елисеев МС, Денисов ИС, Маркелова ЕИ, и др. Независимые факторы риска развития тяжелых сердечно-сосудистых осложнений у мужчин с подагрой: результаты 7-летнего проспективного исследования. Терапевтический архив. 2017;89(5):10-19. doi: 10.17116/terarkh201789510-19.
Fatima T, Nilsson PM, Turesson C, et al. The absolute risk of gout by clusters of gout- associated comorbidities and lifestyle factors-30 years follow-up of the Malmo Preventive Project. Arthritis Res Ther. 2020;22(1):244. doi:10.1186/s13075-020-02339-0.
Evans PL, Prior JA, Belcher J, et al. Obesity, hypertension and diuretic use as risk factors for incident gout: a systematic review and meta-analysis of cohort studies. Arthritis Res Ther. 2018;20(1):136. doi:10.1186/s13075-018-1612-1.
Krishnan E. Chronic kidney disease and the risk of incident gout among middle-aged men: a seven-year prospective observational study. Arthritis Rheum. 2013;65(12):3271-3278. doi:10.1002/art.38171.
Hsu CY, Iribarren C, McCulloch CE, et al. Risk factors for end-stage renal disease: 25- year follow-up. Arch Intern Med. 2009;169(4):342-350.
Ma LD, Sun RX, Xin Y, et al. [Clinical characteristics in gout patients with different body mass index]. Zhonghua Nei Ke Za Zhi. 2017 May 1;56(5):353-357. Chinese. doi: 10.3760/cma.j.issn.0578-1426.2017.05.010.
Richette P, Doherty M, Pascual E, et al. 2018 updated European League Against Rheumatism evidence-based recommendations for the diagnosis of gout. Ann Rheum Dis. 2020;79(1):31-38. doi:10.1136/annrheumdis-2019-215315.
Jamnik J, Rehman S, Blanco Mejia S, et al. Fructose intake and risk of gout and hyperuricemia: a systematic review and meta-analysis of prospective cohort studies. BMJ Open. 2016;6(10):e013191. doi:10.1136/bmjopen-2016-013191.
Chi X, Cen Y, Yang B, et al. Effects of dietary factors on hyperuricaemia and gout: a systematic review and meta-analysis of observational studies. Int J Food Sci Nutr. 2024;75(8):753-773. doi:10.1080/09637486.2024.2400489.
Choi HK, Curhan G. Soft drinks, fructose consumption, and the risk of gout in men: prospective cohort study. BMJ. 2008;336(7639):309-312.
McCormick N, Rai SK, Lu N, et al. Estimation of Primary Prevention of Gout in Men Through Modification of Obesity and Other Key Lifestyle Factors. JAMA Netw Open. 2020;3(11):e2027421. Published 2020 Nov 2. doi:10.1001/jamanetworkopen.2020.27421.
Choi HK, Atkinson
K, Karlson EW, et al. Alcohol intake and risk of incident gout in men: a
prospective study. Lancet. 2004;363(9417):1277-1281.
Gao X, Qi L, Qiao N, et al. Intake of added sugar and sugar-sweetened drink and serum uric acid concentration in US men and women. Hypertension. 2007;50(2):306-312. doi:10.1161/HYPERTENSIONAHA.107.091041.
Choi HK, Willett W, Curhan G. Fructose-rich beverages and risk of gout in women. JAMA. 2010;304(20):2270-2278. doi:10.1001/j ama.2010.1638.
Topless RKG, Major TJ, Florez JC, et al. The comparative effect of exposure to various risk factors on the risk of hyperuricaemia: diet has a weak causal effect. Arthritis Res Ther. 2021;23(1):75. doi:10.1186/s13075-021 -02444-8.
Narang RK, Gamble G, Phipps-Green AJ, et al. Do Serum Urate-associated Genetic Variants Influence Gout Risk in People Taking Diuretics? Analysis of the UK Biobank. J Rheumatol. 2020;47(11):1704-1711. doi:10.3899/jrheum.191005.
Vedder D, Walrabenstein W, Heslinga M, et al. Dietary Interventions for Gout and Effect on Cardiovascular Risk Factors: A Systematic Review. Nutrients. 2019;11(12):2955. doi:10.3390/nu11122955.
Araujo F, Cordeiro I, Teixeira F, et al. Portuguese recommendations for the diagnosis and management of gout. Acta Reumatol Port. 2014;39(2):158-171.
Choi HK, Soriano LC, Zhang Y, Rodriguez LA. Antihypertensive drugs and risk of incident gout among patients with hypertension: population based case-control study. BMJ. 2012;344:d8190. doi:10.1136/bmj.d8190.
Burack DA, Griffith BP, Thompson ME, Kahl LE. Hyperuricemia and gout among heart transplant recipients receiving cyclosporine. Am J Med. 1992;92(2):141-146. doi:10.1016/0002-9343(92)90104-j.
Shapiro M, Hyde L. Hyperuricemia due to pyrazinamide. Am J Med. 1957;23(4):596-599. doi:10.1016/0002-9343(57)90230-9.
Narang RK, Agarwal MC, Raina AK, et al. Hyperuricaemia induced by ethambutol. Br J Dis Chest. 1983;77(4):403-406.
Caspi D, Lubart E, Graff E, et al. The effect of mini-dose aspirin on renal function and uric acid handling in elderly patients. Arthritis Rheum. 2000;43(1):103-108.
Wallace SL, Robinson H, Masi AT, et al. Preliminary criteria for the classification of the acute arthritis of primary gout. Arthritis Rheum. 1977;20(3):895-900. doi:10.1002/art.1780200320.
Neogi T, Jansen TL, Dalbeth N, et al. 2015 Gout classification criteria: an American College of Rheumatology/European League Against Rheumatism collaborative initiative [published correction appears in Ann Rheum Dis. 2016 Feb;75(2):473]. Ann Rheum Dis. 2015;74(10):1789-1798. doi:10.1136/annrheumdis-2015-208237.
Елисеев МС, Владимиров СА. Распространенность и клинические особенности подагры и болезни депонирования пирофосфата кальция у пациентов с острым артритом. Научно-практическая ревматология. 2015;53(4):375-378.
Stewart S, Dalbeth N, Vandal AC, Rome K. The first metatarsophalangeal joint in gout: a systematic review and meta-analysis. BMC Musculoskelet Disord. 2016 Feb 11;17:69. doi: 10.1186/s 12891-016-0919-9.
Taylor WJ, Fransen J, Jansen TL, et al. Study for Updated Gout Classification Criteria: Identification of Features to Classify Gout. Arthritis Care Res (Hoboken). 2015;67(9):1304- 1315. doi:10.1002/acr.22585.
Барскова ВГ. Рациональные подходы к диагностике подагры (по материалам рекомендаций европейской антиревматической лиги). Современная ревматология. 2007;1(1):10-12.
Perez-Ruiz F, Castillo E, Chinchilla SP, Herrero-Beites AM. Clinical manifestations and diagnosis of gout. Rheum Dis Clin North Am. 2014;40(2):193-206.
Janssens HJ, Janssen M, van de Lisdonk EH, et al. Limited validity of the American College of Rheumatology criteria for classifying patients with gout in primary care. Ann Rheum Dis. 2010;69(6):1255-1256. doi:10.1136/ard.2009.123687.
Juraschek SP, Miller ER 3rd, Gelber AC. Body mass index, obesity, and prevalent gout in the United States in 1988-1994 and 2007-2010. Arthritis Care Res (Hoboken). 2013;65(1):127-132. doi:10.1002/acr.21791.
Combe B, Landewe R, Daien CI, et al. 2016 update of the EULAR recommendations for the management of early arthritis. Ann Rheum Dis. 2017;76(6):948-959.
Российские клинические рекомендации. Ревматология. Под ред. Е.Л. Насонова. М.:ГЭОТАР-Медиа, 2017; 253-264.
Malik A, Schumacher HR, Dinnella JE, Clayburne GM. Clinical diagnostic criteria for gout: comparison with the gold standard of synovial fluid crystal analysis. J Clin Rheumatol. 2009 Feb;15(1):22-4. doi:10.1097/RHU.0b013e3181945b79.
Pascual E, Doherty M. Aspiration of normal or asymptomatic pathological joints for diagnosis and research: indications, technique and success rate. Ann Rheum Dis. 2009;68(1):3-7. doi:10.1136/ard.2008.088328.
Pascual E, Sivera F. Time required for disappearance of urate crystals from synovial fluid after successful hypouricaemic treatment relates to the duration of gout. Ann Rheum Dis. 2007;66(8):1056-1058. doi:10.1136/ard.2006.060368.
Taylor WJ, Fransen J, Dalbeth N, et al. Diagnostic Arthrocentesis for Suspicion of Gout Is Safe and Well Tolerated. J Rheumatol. 2016;43(1):150-153. doi:10.3899/jrheum.150684.
Parker JD, Capell HA. An acute arthritis clinic--one year's experience. Br J Rheumatol. 1986;25(3):293-295. doi:10.1093/rheumatology/25.3.293.
Freed JF, Nies KM, Boyer RS, Louie JS. Acute monoarticular arthritis. A diagnostic approach. JAMA. 1980;243(22):2314-2316.
Shmerling RH, Delbanco TL, Tosteson AN, Trentham DE. Synovial fluid tests. What should be ordered? JAMA. 1990;264(8):1009-1014.
Jeng GW, Wang CR, Liu ST, et al. Measurement of synovial tumor necrosis factor-alpha in diagnosing emergency patients with bacterial arthritis. Am J Emerg Med. 1997;15(7):626- 629. doi:10.1016/s0735 -6757(97)90173-x.
Maki DG. Risk for septic arthritis was increased in adults with incident diagnosis of gout. Ann Intern Med. 2015;163(12):JC12. doi:10.7326/ACPJC-2015-163-12-012.
Yu KH, Luo SF, Liou LB, et al. Concomitant septic and gouty arthritis--an analysis of 30 cases. Rheumatology (Oxford). 2003;42(9):1062-1066. doi:10.1093/rheumatology/keg297
Richette P, Doherty M, Pascual E, et al. 2016 updated EULAR evidence-based recommendations for the management of gout. Ann Rheum Dis. 2017;76(1):29-42. doi:10.1136/annrheumdis-2016-209707.
Bhole V, de Vera M, Rahman MM, Krishnan E, Choi H. Epidemiology of gout in women: Fifty-two-year followup of a prospective cohort. Arthritis Rheum. 2010;62(4):1069-1076. doi:10.1002/art.27338.
Lin KC, Lin HY, Chou P. The interaction between uric acid level and other risk factors on the development of gout among asymptomatic hyperuricemic men in a prospective study. J Rheumatol. 2000;27(6):1501-1505.
Neilson J, Bonnon A, Dickson A, Roddy E; Guideline Committee. Gout: diagnosis and management-summary of NICE guidance. BMJ. 2022;378:o1754. doi:10.1136/bmj.o1754.
Lu J, Zhang Q, Yang G, Gu Z, Wu Y. Analysis of Superb Microvascular Imaging Blood Flow Scoring, Disease Duration, and Laboratory Indicators Involved in Gout. J Clin Ultrasound. doi:10.1002/jcu.23940.
Jiang Y, Tu X, Liao X, et al. New Inflammatory Marker Associated with Disease Activity in Gouty Arthritis: The Systemic Inflammatory Response Index. J Inflamm Res. 2023;16:5565-5573. doi:10.2147/JIR.S432898.
Bardin T, Richette P. Impact of comorbidities on gout and hyperuricaemia: an update on prevalence and treatment options. BMC Med. 2017;15(1):123. Published 2017 Jul 3. doi:10.1186/s12916-017-0890-9.
San Gabriel DED, Slark J. The association of gout with an increased risk of hypertension and diabetes mellitus among stroke survivors in New Zealand: A cross-sectional study using routinely collected electronic health data. JRSM Cardiovasc Dis. 2019;8:2048004019863239. Published 2019 Jul 19. doi:10.1177/2048004019863239.
Российская ассоциация эндокринологов. Клинические рекомендации. Сахарный диабет 2 типа у взрослых. 2022.
Li L, Lip GYH, Li S, Adachi JD, Thabane L, Li G. Associations between glycated hemoglobin and the risks of incident cardiovascular diseases in patients with gout. Cardiovasc Diabetol. 2022;21(1):133. Published 2022 Jul 15. doi:10.1186/s12933-022- 01567-9.
Fhima F, El Amri N, Khalifa D, et al. AB1069. Uric Acid Levels In Relation To Fasting Blood Glucose And HbA1c. Annals of the Rheumatic Diseases 2022;81:1654.
Lai HM, Chen CJ, Su BY, et al. Gout and type 2 diabetes have a mutual inter-dependent effect on genetic risk factors and higher incidences. Rheumatology (Oxford). 2012;51(4):715 -720. doi:10.1093/rheumatology/ker373.
Елисеев МС, Барскова В.Г. Нарушения углеводного обмена при подагре: частота выявления и клинические особенности. Терапевтический архив. 2010; 82(5):50-54.
Richette P, Clerson P, Perissin L, et al. Revisiting comorbidities in gout: a cluster analysis. Ann Rheum Dis. 2015;74(1):142-147. doi:10.1136/annrheumdis-2013-203779.
Дедов ИИ, Шестакова МВ, Майорова АЮ, и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом. 9-й выпуск.2019.
Johnson RJ, Titte S, Cade JR, et al. Uric acid, evolution and primitive cultures. Semin Nephrol. 2005;25(1):3-8. doi:10.1016/j.semnephrol.2004.09.002.
Li HN, Liu
J, Shao Z, Xiong W, Cheng L. Gouty arthritis patients' diagnostic, biochemical,
and hematological characteristics study: a single-center retrospective study.
BMC Musculoskelet Disord. 2024;25(1):1054.
Han L, Zhang L, Hu W, Lu Y, Wang Z. Association of C-reactive protein with all-cause and cause-specific mortality in people with gout. Eur J Med Res. 2024;29(1):320. doi:10.1186/s40001 -024-01923-3.
100.Schlesinger N, Alten RE, Bardin T, Schumacher HR, Bloch M, Gimona A, Krammer G, Murphy V, Richard D, So AK. Canakinumab for acute gouty arthritis in patients with limited treatment options: results from two randomised, multicentre, active-controlled, double-blind trials and their initial extensions. Ann Rheum Dis. 2012 Nov;71(11):1839-48. Doi: 10.1136/annrheumdis-2011-200908. Epub 2012 May 14. PMID: 22586173.
De Cosmo S, Viazzi F, Pacilli A, et al. Serum Uric Acid and Risk of CKD in Type 2 Diabetes. Clin J Am Soc Nephrol. 2015;10(11):1921-1929. doi:10.2215/CJN.03140315.
Jaffe DH, Klein AB, Benis A, et al. Incident gout and chronic Kidney Disease: healthcare utilization and survival. BMC Rheumatol. 2019;3:11. Published 2019 Mar 19. doi:10.1186/s41927-019-0060-0.
Елисеев МС. Гиперурикемия как фактор поражения почек и мишень терапии. Эффективная фармакотерапия. 2020;16(6):30-35. doi: 10.33978/2307-3586-2020-16-6- 30-35.
Roughley MJ, Belcher J, Mallen CD, Roddy E. Gout and risk of chronic kidney disease and nephrolithiasis: meta-analysis of observational studies. Arthritis Res Ther. 2015;17(1):90. Published 2015 Apr 1. doi:10.1186/s13075-015-0610-9.
Ahmed S, Subash T, Ahmed H, Sadiqa A, Yaqub S, Jafri L. Diagnostic Accuracy of Creatinine-Based Equations for eGFR Estimation in Pakistanis: Evaluation of the European Kidney Function Consortium Equation vs the CKD-EPI Pakistan Equation. EJIFCC. 2024;35(4):285-293.
Gharipour M, Sadeghi M, Nezafati P, Dianatkhah M, Sarrafzadegan N. Cardiovascular Disease Risk Assessment: Triglyceride/High-Density Lipoprotein versus Metabolic Syndrome Criteria. J Res Health Sci. 2019 May 13;19(2):e00442.
Kuwabara M, Borghi C, Cicero AFG, et al. Elevated serum uric acid increases risks for developing high LDL cholesterol and hypertriglyceridemia: A five-year cohort study in Japan. Int J Cardiol. 2018;261:183-188. doi:10.1016/j.ijcard.2018.03.045.
Russo E, Viazzi F, Pontremoli R, et al. Association of uric acid with kidney function and albuminuria: the Uric Acid Right for heArt Health (URRAH) Project [published online ahead of print, 2021 Mar 23]. J Nephrol. 2021;10.1007/s40620-021-00985-4. doi:10.1007/s40620-021-00985-4.
Su X, Xu B, Yan B, et al. Effects of uric acid-lowering therapy in patients with chronic kidney disease: A meta-analysis. PLoS One. 2017;12(11):e0187550. Published 2017 Nov 2. doi:10.1371/journal.pone.0187550.
Канакинумаб (Иларис®). Государственный реестр лекарственных средств. View v2.aspx?routingGuid=011c2bd7-a3f5-4750-80ef- 52c6cf58051b (дата обращения 04.05.2024).
Ortiz-Brizuela E, Apriani L, Mukherjee T, et al. Assessing the Diagnostic Performance of New Commercial Interferon-y Release Assays for Mycobacterium tuberculosis Infection: A Systematic Review and Meta-Analysis. Clin Infect Dis. 2023;76(11):1989-1999. doi:10.1093/cid/ciad030.
Zhou G, Luo
Q, Luo S, et al. Interferon-y release assays or tuberculin skin test for
detection and management of latent tuberculosis infection: a systematic review
and meta-analysis. Lancet Infect Dis. 2020;20(12):1457-1469.
Mrozek N, Pereira B, Soubrier M, Gourdon F, Laurichesse H. Screening of tuberculosis before biologics. Med Mal Infect. 2012;42(1):1-4. doi:10.1016/j.medmal.2011.08.002.
Avena-Woods C, Hilas O. Febuxostat (Uloric), A New Treatment Option for Gout. P T. 2010 Feb;35(2):82-5.
Hoeltzenbein
M, Stieler K, Panse M, et al. Allopurinol Use during Pregnancy - Outcome of 31
Prospectively Ascertained Cases and a Phenotype Possibly Indicative for
Teratogenicity. PLoS One. 2013;8(6):e66637.
Kozenko M, Grynspan D, Oluyomi-Obi T, Sitar D, Elliott AM, Chodirker BN. Potential teratogenic effects of allopurinol: a case report. Am J Med Genet A. 2011;155A(9):2247- 2252. doi:10.1002/ajmg.a.34139.
Patel AV, Gaffo AL. Managing Gout in Women: Current Perspectives. J Inflamm Res. 2022;15:1591-1598. Published 2022 Mar 3. doi:10.2147/JIR.S284759.
Mathieu S, Pereira B, Couderc M, Soubrier M. Usefulness of ultrasonography in the diagnosis of gout: a meta-analysis. Ann Rheum Dis. 2013;72(10):e23. doi:10.1136/annrheumdis-2013-204108.
Lee YH, Song GG. Diagnostic accuracy of ultrasound in patients with gout: A metaanalysis. Semin Arthritis Rheum. 2018;47(5):703-709.
Ogdie A, Taylor WJ, Neogi T, et al. Performance of Ultrasound in the Diagnosis of Gout in a Multicenter Study: Comparison With Monosodium Urate Monohydrate Crystal Analysis as the Gold Standard. Arthritis Rheumatol. 2017;69(2):429-438. doi:10.1002/art.39959.
Якунина ИА, Ильиных ЕВ, Удельнова ИА и др. Частота выявления симптома «пробойника» при рентгенологическом исследовании дистальных отделов стоп больных с подагрой: связь с длительностью болезни и течением артрита. Научнопрактическая ревматология. 2003;2:222-231.
Hoff LS, Goldenstein-Schainberg C, Fuller R. Nephrolithiasis in gout: prevalence and characteristics of Brazilian patients. Adv Rheumatol. 2019;60(1):2. Published 2019 Dec 31. doi:10.1186/s42358-019-0106-4.
Alvarez-Nemegyei J, Medina-Escobedo M, Villanueva-Jorge S, Vazquez-Mellado J. Prevalence and risk factors for urolithiasis in primary gout: is a reappraisal needed?. J Rheumatol. 2005;32(11):2189-2191.
Kramer HJ, Choi HK, Atkinson K, et al. The association between gout and nephrolithiasis in men: The Health Professionals' Follow-Up Study. Kidney Int. 2003;64(3):1022-1026. doi:10.1046/j.1523-1755.2003.t01-2-00171.x.
Wyngaarden J.B., Kelley W.N. Gout and hyperuricemia. 1976:233-252.
126.Shang J, Zhou LP, Wang H, Liu B. Diagnostic Performance of Dual-energy CT Versus Ultrasonography in Gout: A Meta-analysis. Acad Radiol. 2022 Jan;29(1):56-68. doi: 10.1016/j.acra.2020.08.030.
Gamala M, Jacobs JWG, van Laar JM. The diagnostic performance of dual energy CT for diagnosing gout: a systematic literature review and meta-analysis. Rheumatology (Oxford). 2019;58(12):2117-2121. doi:10.1093/rheumatology/kez180.
Chen J, Liao M, Zhang H, Zhu D. Diagnostic accuracy of dual-energy CT and ultrasound in gouty arthritis: A systematic review. Z Rheumatol. 2017 Oct;76(8):723-729. English. doi: 10.1007/s00393-016-0250-8.
Bindu S, Mazumder S, Bandyopadhyay U. Non-steroidal anti-inflammatory drugs (NSAIDs) and organ damage: A current perspective. Biochem Pharmacol. 2020 Oct;180:114147. doi: 10.1016/j.bcp.2020.114147. Epub 2020 Jul 10. PMID: 32653589; PMCID: PMC7347500, James DS. The multisystem adverse effects of NSAID therapy. J Am Osteopath Assoc. 1999 Nov 1;99(11_suppl):S1-S7. doi: 10.7556/jaoa.1999.99.11.S1. PMID: 26981697.
Lanas A,
Boers M, Nuevo J. Gastrointestinal events in at-risk patients starting
non-steroidal anti-inflammatory drugs (NSAIDs) for rheumatic diseases: the
EVIDENCE study of European
routine practice. Ann Rheum Dis. 2015;74(4):675-681.
Каратеев АЕ, Насонов ЕЛ, Ивашкин ВТ, и др. Рациональное
использование нестероидных противовоспалительных препаратов. Клинические
рекомендации. Научно-практическая ревматология. 2018;56:1-29.
Arfe A, Scotti L, Varas-Lorenzo C, et al. Non-steroidal anti-inflammatory drugs and risk of heart failure in four European countries: nested case-control study. BMJ. 2016;354:i4857. doi:10.1136/bmj.i4857.
Wang X, Li X, Wang H, et al. All-cause and specific mortality in patients with gout: A systematic review and meta-analysis. Semin Arthritis Rheum. 2023;63:152273. doi:10.1016/j.semarthrit.2023.152273.
Kawasoe S, Kubozono T, Yoshifuku S, et al. Uric Acid Level and Prevalence of Atrial Fibrillation in a Japanese General Population of 285,882. Circ J. 2016;80(12):2453-2459. doi:10.1253/circj.CJ-16-0766.
Lee SJ, Oh BK, Sung KC. Uric acid and cardiometabolic diseases. Clin Hypertens. 2020;26:13. doi:10.1186/s40885-020-00146-y.
Huang H, Huang B, Li Y, et al. Uric acid and risk of heart failure: a systematic review and meta-analysis. Eur J Heart Fail. 2014;16(1):15-24. doi:10.1093/eurjhf/hft132.
Kearney PM,
Baigent C, Godwin J, at al. Do selective cyclo-oxygenase-2 inhibitors and
traditional non-steroidal anti-inflammatory drugs increase the risk of
atherothrombosis? Meta-analysis of randomised trials. BMJ. 2006;332:1302-8.
Garda
Rodriguez LA, Tacconelli S, Patrignani P. Role of dose potency in the
prediction of risk of myocardial infarction associated with nonsteroidal
anti-inflammatory drugs in the general population. J Am Coll Cardiol.
2008;52:1628-36.
McGettigan P, Henry D. Cardiovascular risk with non-steroidal anti-inflammatory drugs: systematic review of population-based controlled observational studies. PLoS Med. 2011;8:e1001098. doi:10.1371/journal.pmed.1001098 pmid:21980265.
Trelle S, Reichenbach S, Wandel S, et al. Cardiovascular safety of non-steroidal antiinflammatory drugs: network meta-analysis. BMJ. 2011;342:c7086. doi:10.1136/bmj.c7086 pmid:21224324.
Bhala N, Emberson J, Merhi A, et al. Coxib and traditional NSAID Trialists’ (CNT) Collaboration. Vascular and upper gastrointestinal effects of non-steroidal antiinflammatory drugs: meta-analyses of individual participant data from randomised trials. Lancet. 2013;382:769-79. doi:10.1016/S0140-6736(13)60900-9 pmid:23726390.
Vilaca T, Eastell R, Schini M. Osteoporosis in men. Lancet Diabetes Endocrinol. 2022 Apr;10(4):273-283. doi:10.1016/S2213-8587(22)00012-2.
Anam AK, Insogna K. Update on Osteoporosis Screening and Management. Med Clin North Am. 2021; 105(6): 1117-1134. doi:10.1016/j.mcna.2021.05.016.
Kaul S, Gupta M, Bandyopadhyay D, Hajra A, Deedwania P, Roddy E, Mamas M, Klein A, Lavie CJ, Fonarow GC, Ghosh RK. Gout Pharmacotherapy in Cardiovascular Diseases: A Review of Utility and Outcomes. Am J Cardiovasc Drugs. 2021 Sep;21(5):499-512. doi: 10.1007/s40256-020-00459-1.
Colantonio
LD, Saag KG, Singh JA, et al. Gout is associated with an increased risk for
incident heart failure among older adults: the REasons for Geographic And
Racial Differences in Stroke (REGARDS) cohort study. Arthritis Res Ther. 2020;22(1):86.
doi:10.1186/s13075-020-02175-2. van Durme
CM, Wechalekar MD, Landewe RB, et al. Non-steroidal anti-inflammatory drugs for
acute gout. Cochrane Database Syst Rev. 2021;12(12):CD010120.
FitzGerald JD, Dalbeth N, Mikuls T, et al. 2020 American College of Rheumatology Guideline for the Management of Gout [published correction appears in Arthritis Care Res (Hoboken). 2020 Aug;72(8):1187. doi: 10.1002/acr.24401.] [published correction appears in Arthritis Care Res (Hoboken). 2021 Mar;73(3):458. doi: 10.1002/acr.24566.]. Arthritis Care Res (Hoboken). 2020;72(6):744-760. doi:10.1002/acr.24180.
Li S, Yang H, Guo Y, et al. Comparative efficacy and safety of urate-lowering therapy for the treatment of hyperuricemia: a systematic review and network meta-analysis. Sci Rep. 2016;6:33082. doi:10.1038/srep33082.
Pascart T, Latourte A, Flipo RM, et al. 2020 recommendations from the French Society of Rheumatology for the management of gout: Urate-lowering therapy. Joint Bone Spine. 2020;87(5):395-404. doi:10.1016/j.jbspin.2020.05.002.
Hui M, Carr A, Cameron S, et al. The British Society for Rheumatology Guideline for the Management of Gout. Rheumatology (Oxford). 2017;56(7):1246. doi:10.1093/rheumatology/kex250.
Jeyaruban A, Larkins S, Soden M. Management of gout in general practice--a systematic review. Clin Rheumatol. 2015;34(1):9-16. doi:10.1007/s10067-014-2783-z.
Conley B, Bunzli S, Bullen J, et al. What are the core recommendations for gout management in first line and specialist care? Systematic review of clinical practice guidelines. BMC Rheumatol. 2023;7(1):15. doi:10.1186/s41927-023-00335-w.
Yu Y, Wang D, Zhou Q, et al. Recommendations in clinical practice guidelines on gout: systematic review and consistency analysis. Clin Exp Rheumatol. 2020;38(5):964-972.
Terkeltaub RA. Colchicine update: 2008. Semin Arthritis Rheum. 2009;38(6):411-419. doi:10.1016/j.semarthrit.2008.08.006.
Dalbeth N, Merriman TR, Stamp LK. Gout. Lancet. 2016;388(10055):2039-2052. doi:10.1016/S0140-6736(16)00346-9.
Doherty M, Jansen TL, Nuki G, et al. Gout: why is this curable disease so seldom cured?. Ann Rheum Dis. 2012;71(11):1765-1770. doi:10.1136/annrheumdis-2012-201687.
Keenan RT, O'Brien WR, Lee KH, et al. Prevalence of contraindications and prescription of pharmacologic therapies for gout. Am J Med. 2011;124(2):155-163. doi:10.1016/j.amjmed.2010.09.012.
Zhang W, Doherty M, Bardin T, et al. EULAR evidence based recommendations for gout. Part II: Management. Report of a task force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis. 2006;65(10):1312-1324. doi:10.1136/ard.2006.055269.
McKenzie BJ, Wechalekar MD, Johnston RV, et al. Colchicine for acute gout. Cochrane Database Syst Rev. 2021;8(8):CD006190. Published 2021 Aug 26. doi:10.1002/14651858.CD006190.pub3.
Wechalekar MD, Vinik O, Moi JH, et al. The efficacy and safety of treatments for acute gout: results from a series of systematic literature reviews including Cochrane reviews on intraarticular glucocorticoids, colchicine, nonsteroidal antiinflammatory drugs, and interleukin-1 inhibitors. J Rheumatol Suppl. 2014;92:15-25. doi:10.3899/jrheum.140458.
Billy CA, Lim RT, Ruospo M, et al. Corticosteroid or Nonsteroidal Antiinflammatory Drugs for the Treatment of Acute Gout: A Systematic Review of Randomized Controlled Trials. J Rheumatol. 2018;45(1):128-136. doi:10.3899/jrheum.170137.
Yu J, Lu H, Zhou J, et al. Oral prednisolone versus non-steroidal anti-inflammatory drugs in the treatment of acute gout: a meta-analysis of randomized controlled trials [published correction appears in Inflammopharmacology. 2019 Feb;27(1):199. doi: 10.1007/s10787- 018-0518-5.]. Inflammopharmacology. 2018;26(3):717-723. doi:10.1007/s10787-018- 0442-8.
Janssens HJ, Lucassen PL, Van de Laar FA, Janssen M, Van de Lisdonk EH. Systemic corticosteroids for acute gout. Cochrane Database Syst Rev. 2008;2008(2):CD005521. doi:10.1002/14651858.CD005521.pub2.
Reardon JA, Stockman A, Darlington LG, Scott JT. Double-blind trial of feprazone and phenylbutazone in acute gout. Curr Med Res Opin. 1980;6(7):445-448. doi:10.1185/03007998009109465.
Ruotsi A, Vainio U. Treatment of acute gouty arthritis with proquazone and indomethacin. A comparative, double-blind trial. Scand J Rheumatol Suppl. 1978;(21):15-17. doi:10.3109/03009747809095668.
Shrestha M,
Morgan DL, Moreden JM, et al. Randomized double-blind comparison of the
analgesic efficacy of intramuscular ketorolac and oral indomethacin in the
treatment of acute gouty arthritis. Ann Emerg Med. 1995;26(6):682-686.
Siegmeth W, Placheta P. Doppelblindstudie: Ketoprofen gegen Phenylbutazon bei akuter Gichtarthritis [Double-blind trial: ketoprofen versus phenylbutazone in acute gouty arthritis (author's transl)]. Wien Klin Wochenschr. 1976;88(16):535-537.
Weiner GI, White SR, Weitzner RI, Rubinstein HM. Double-blind study of fenoprofen versus phenylbutazone in acute gouty arthritis. Arthritis Rheum. 1979;22(4):425-426. doi:10.1002/art.1780220420.
Terkeltaub RA, Furst DE, Bennett K, et al. High versus low dosing of oral colchicine for early acute gout flare: Twenty-four-hour outcome of the first multicenter, randomized, double-blind, placebo-controlled, parallel-group, dose-comparison colchicine study. Arthritis Rheum. 2010;62(4):1060-1068. doi:10.1002/art.27327.
Groff GD, Franck WA, Raddatz DA. Systemic steroid therapy for acute gout: a clinical trial and review of the literature. Semin Arthritis Rheum. 1990;19(6):329-336. doi: 10.1016/0049-0172(90)90070-v.
Janssens HJ, Janssen M, van de Lisdonk EH, et al. Use of oral prednisolone or naproxen for the treatment of gout arthritis: a double-blind, randomised equivalence trial. Lancet. 2008;371(9627):1854-1860. doi:10.1016/S0140-6736(08)60799-0.
Федорова АА, Барскова ВГ, Якунина ИА, и др. Кратковременное применение глюкокортикоидов у больных с затяжным и хроническим подагрическим артритом. Часть II- сравнение эффективности различных лекарственных форм. Научнопрактическая ревматология. 2008;46(5):72-75.
Ahern MJ, Reid C, Gordon TP, et al. Does colchicine work? The results of the first controlled study in acute gout. Aust N Z J Med. 1987;17(3):301-304. doi: 10.1111/j .1445- 5994.1987.tb01232.x.
Roddy E, Clarkson K, Blagojevic-Bucknall M, et al. Open-label randomised pragmatic trial (CONTACT) comparing naproxen and low-dose colchicine for the treatment of gout flares in primary care. Ann Rheum Dis. 2020;79(2):276-284. doi:10.1136/annrheumdis- 2019-216154.
Pascart T, Robinet P, Ottaviani S, et al. Evaluating the safety and short-term equivalence of colchicine versus prednisone in older patients with acute calcium pyrophosphate crystal arthritis (COLCHICORT): an open-label, multicentre, randomised trial. Lancet Rheumatol. 2023;5(9):e523-e531. doi:10.1016/S2665-9913(23)00165-0.
Hansten PD, Tan MS, Horn JR, et al. Colchicine Drug Interaction Errors and Misunderstandings: Recommendations for Improved Evidence-Based Management. Drug Saf. 2023;46(3):223-242. doi:10.1007/s40264-022-01265-1.
Stamp LK, Horsley C, Karu LT, et al. Colchicine: the good, the bad, the ugly, and how to minimise the risks. Rheumatology (Oxford). 2023 Nov 29:kead625. doi: 10.1093/rheumatology/kead625.
Stewart S, Yang KCK, Atkins K, et al. Adverse events during oral colchicine use: a systematic review and meta-analysis of randomised controlled trials. Arthritis Res Ther. 2020;22(1):28. doi:10.1186/s13075-020-2120-7. van Echteld I, Wechalekar MD, Schlesinger N, et al. Colchicine for acute gout. Cochrane Database Syst Rev. 2014;(8):CD006190. doi:10.1002/14651858.CD006190.pub2.
Finkelstein Y, Aks SE, Hutson JR, et al. Colchicine poisoning: the dark side of an ancient drug. Clin Toxicol (Phila). 2010;48(5):407-414. doi:10.3109/15563650.2010.495348.
Wason S,
Mount D, Faulkner R. Single-dose, open-label study of the differences in
pharmacokinetics of colchicine in subjects with renal impairment, including
end-stage renal disease. Clin Drug Investig. 2014;34(12):845-855.
Terkeltaub RA, Furst DE, Digiacinto JL, et al. Novel evidence-based colchicine dose- reduction algorithm to predict and prevent colchicine toxicity in the presence of cytochrome P450 3A4/P-glycoprotein inhibitors [published correction appears in Arthritis Rheum. 2011 Nov;63(11):3521. Dosage error in article text]. Arthritis Rheum. 2011;63(8):2226-2237. doi:10.1002/art.30389.
Terkeltaub RA. Clinical practice. Gout. N Engl J Med. 2003;349(17):1647-1655. doi:10.1056/NEJMcp030733.
Slobodnick A, Shah B, Krasnokutsky S, Pillinger MH. Update on colchicine, 2017. Rheumatology (Oxford). 2018;57(suppl_1):i4-i11. doi:10.1093/rheumatology/kex453.
Liu X, Sun D, Ma X, et al. Benefit-risk of corticosteroids in acute gout patients: An updated meta-analysis and economic evaluation. Steroids. 2017;128:89-94. doi:10.1016/j.steroids.2017.09.002.
Rainer TH, Cheng CH, Janssens HJ, et al. Oral Prednisolone in the Treatment of Acute Gout: A Pragmatic, Multicenter, Double-Blind, Randomized Trial. Ann Intern Med. 2016;164(7):464-471. doi: 10.7326/M14-2070.
Федорова АА, Барскова ВГ, Якунина ИА, Насонова ВА. Кратковременное применение глюкокортикоидов у больных затяжным и хроническим подагрическим артритом. Часть III - частота развития нежелательных реакций. Научно-практическая ревматология. 2009;47(2):38-42.
Yasir M, Goyal A, Sonthalia S. Corticosteroid Adverse Effects. In: StatPearls. Treasure Island (FL): StatPearls Publishing; July 3, 2023.
Барскова ВГ, Кудаева ФМ. Применение гранулированной формы нимесулида при подагре. РМЖ. 2007;26:2020.
Барскова ВГ, Якунина ИА, Насонова ВА. Применение нимесила при подагрическом артрите. Терапевтических архив. 2003; 5: 60-4.
Kress HG, Baltov A, Basinski A, et al. Acute pain: a multifaceted challenge - the role of nimesulide. Curr Med Res Opin. 2016;32(1):23-36. doi:10.1185/03007995.2015.1100986.
Franck WA, Brown MM. Letter: Ibuprofen in acute polyarticular gout. Arthritis Rheum. 1976;19(2):269. doi:10.1002/art.1780190225.
Zeng L,
Qasim A, Neogi T, et al. Efficacy and Safety of Pharmacologic Interventions in
Patients Experiencing a Gout Flare: A Systematic Review and Network
MetaAnalysis. Arthritis Care Res (Hoboken). 2021;73(5):755-764.
Soliman S, Ahmed RM, Ahmed MM, et al. Non-steroidal anti-inflammatory drugs: what is the actual risk of chronic kidney disease? A systematic review and meta-analysis. Rom J Intern Med. 2025;63(1):3-27. doi:10.2478/rjim-2024-0029.
Martin Arias LH, Martin Gonzalez A, Sanz Fadrique R, Vazquez ES. Cardiovascular Risk of Nonsteroidal Anti-inflammatory Drugs and Classical and Selective Cyclooxygenase-2 Inhibitors: A Meta-analysis of Observational Studies. J Clin Pharmacol. 2019;59(1):55-73. doi:10.1002/jcph.1302.
Bally M, Dendukuri N, Rich B, et al. Risk of acute myocardial infarction with NSAIDs in real world use: bayesian meta-analysis of individual patient data. BMJ. 2017;357:j1909. doi:10.1136/bmj.j1909.
Schmidt M, S0rensen HT, Pedersen L. Diclofenac use and cardiovascular risks: series of nationwide cohort studies. BMJ. 2018;362:k3426. doi:10.1136/bmj.k3426.
Saag KG, Khanna PP, Keenan RT, et al. A Randomized, Phase II Study Evaluating the Efficacy and Safety of Anakinra in the Treatment of Gout Flares. Arthritis Rheumatol. 2021;73(8):1533-1542. doi: 10.1002/art.41699.
So A, De Smedt T, Revaz S, Tschopp J. A pilot study of IL-1 inhibition by anakinra in acute gout. Arthritis Res Ther. 2007;9(2):R28. doi:10.1186/ar2143.
Martinon F, Petrilli V, Mayor A, et al. Gout-associated uric acid crystals activate the NALP3 inflammasome. Nature. 2006;440(7081):237-241. doi:10.1038/nature04516.
Bursill D, Taylor WJ, Terkeltaub R, et al. Gout, Hyperuricemia, and Crystal-Associated Disease Network Consensus Statement Regarding Labels and Definitions for Disease Elements in Gout. Arthritis Care Res (Hoboken). 2019;71(3):427-434.
Lee YH, Song GG. Effect of urate-lowering therapy on all-cause and CVD-specific mortality in gout and hyperuricemia: a meta-analysis. Auswirkungen von harnsauresenkender Therapie auf die Gesamt- und die kardiovaskulare Mortalitat bei Gicht und Hyperurikamie: eine Metaanalyse. Z Rheumatol. 2024;83(Suppl 3):338-344. doi:10.1007/s00393 -024-01600-0.
Perez Ruiz F, Richette P, Stack AG, et al. Failure to reach uric acid target of <0.36 mmol/L in hyperuricaemia of gout is associated with elevated total and cardiovascular mortality. RMD Open. 2019;5(2):e001015.. doi:10.1136/rmdopen-2019-001015.
Pagidipati NJ, Clare RM, Keenan RT, et al. Association of Gout With Long-Term Cardiovascular Outcomes Among Patients With Obstructive Coronary Artery Disease. J Am Heart Assoc. 2018;7(16):e009328. doi:10.1161/JAHA.118.009328.
Bardin T. Hyperuricemia starts at 360 micromoles (6 mg/dL). Joint Bone Spine. 2015;82(3):141-143. doi:10.1016/j.jbspin.2015.01.002.
Goldfien R, Pressman A, Jacobson A, et al. A Pharmacist-Staffed, Virtual Gout Management Clinic for Achieving Target Serum Uric Acid Levels: A Randomized Clinical Trial. Perm J. 2016;20(3):15-234. doi:10.7812/TPP/15-234.
Mikuls TR, Cheetham TC, Levy GD, et al. Adherence and Outcomes with Urate-Lowering Therapy: A Site-Randomized Trial. Am J Med. 2019;132(3):354-361.
Ellmann H, Bayat S, Araujo E, et al. Effects of Conventional Uric Acid-Lowering Therapy on Monosodium Urate Crystal Deposits. Arthritis Rheumatol. 2020;72(1):150-156. doi:10.1002/art.41063.
Pascart T, Grandjean A, Capon B, et al. Monosodium urate burden assessed with dualenergy computed tomography predicts the risk of flares in gout: a 12-month observational study: MSU burden and risk of gout flare. Arthritis Res Ther. 2018;20(1):210. doi:10.1186/s13075-018-1714-9.
Doherty M, Jenkins W, Richardson H, et al. Efficacy and cost-effectiveness of nurse-led care involving education and engagement of patients and a treat-to-target urate-lowering strategy versus usual care for gout: a randomised controlled trial. Lancet. 2018;392(10156):1403-1412. doi:10.1016/S0140-6736(18)32158-5.
Stamp LK, Frampton C, Morillon MB, et al. Association between serum urate and flares in people with gout and evidence for surrogate status: a secondary analysis of two randomised controlled trials. Lancet Rheumatol. 2022;4(1):e53-e60.
Schretlen DJ, Inscore AB, Vannorsdall TD, et al. Serum uric acid and brain ischemia in normal elderly adults. Neurology. 2007;69(14):1418-1423.
Chen H, Mosley TH, Alonso A, Huang X. Plasma urate and Parkinson's disease in the Atherosclerosis Risk in Communities (ARIC) study. Am J Epidemiol. 2009;169(9):1064- 1069. doi:10.1093/aje/kwp033.
Weisskopf MG, O'Reilly E, Chen H, et al. Plasma urate and risk of Parkinson's disease. Am J Epidemiol. 2007;166(5):561-567. doi:10.1093/aje/kwm127.
Kim TS, Pae CU, Yoon SJ, et al. Decreased plasma antioxidants in patients with Alzheimer's disease. Int J Geriatr Psychiatry. 2006;21(4):344-348. doi:10.1002/gps.1469.
Abraham A, Drory VE. Influence of serum uric acid levels on prognosis and survival in amyotrophic lateral sclerosis: a meta-analysis. J Neurol. 2014;261(6):1133-1138. doi:10.1007/s00415-014-7331-x.
Taylor TH, Mecchella JN, Larson RJ, et al. Initiation of allopurinol at first medical contact for acute attacks of gout: a randomized clinical trial. Am J Med. 2012;125(11):1126- 1134.e7. doi:10.1016/j.amjmed.2012.05.025.
.Seth R, Kydd AS, Buchbinder R, et al. Allopurinol for chronic gout. Cochrane Database Syst Rev. 2014;2014(10):CD006077. doi:10.1002/14651858.CD006077.pub3.
Perez-Ruiz F, Herrero-Beites AM, Carmona L. A two-stage approach to the treatment of hyperuricemia in gout: the "dirty dish" hypothesis. Arthritis Rheum. 2011;63(12):4002- 4006. doi:10.1002/art.30649.
Schumacher HR Jr, Becker MA, Wortmann RL, et al. Effects of febuxostat versus allopurinol and placebo in reducing serum urate in subjects with hyperuricemia and gout: a 28-week, phase III, randomized, double-blind, parallel-group trial. Arthritis Rheum. 2008;59(11):1540-1548. doi:10.1002/art.24209.
O'Dell JR, Brophy MT, Pillinger MH, et al. Comparative Effectiveness of Allopurinol and Febuxostat in Gout Management [published correction appears in NEJM Evid. 2022 Jul;1(7):EVIDx2200150. doi: 10.1056/EVIDx2200150.] [published correction appears in NEJM Evid. 2022 Aug;1(8):EVIDx2200180. doi: 10.1056/EVIDx2200180.]. NEJM Evid. 2022;1(3):10.1056/evidoa2100028. doi:10.1056/evidoa2100028.
Jutkowitz E, Choi HK, Pizzi LT, Kuntz KM. Cost-effectiveness of allopurinol and febuxostat for the management of gout. Ann Intern Med. 2014;161(9):617-626. doi:10.7326/M14-0227.
Dalbeth N, Kumar S, Stamp L, Gow P. Dose adjustment of allopurinol according to creatinine clearance does not provide adequate control of hyperuricemia in patients with gout. J Rheumatol. 2006;33(8):1646-1650.
Yokose C, Lu N, Xie H, et al. Heart disease and the risk of allopurinol-associated severe cutaneous adverse reactions: a general population-based cohort study. CMAJ. 2019;191(39):E1070-E1077. doi:10.1503/cmaj.190339.
Jennings CG, Mackenzie IS, Flynn R, et al. Up-titration of allopurinol in patients with gout. Semin Arthritis Rheum. 2014;44(1):25-30. doi:10.1016/j.semarthrit.2014.01.004.
Елисеев М.С., Чикина М.Н., Желябина О.В. Открытое 6-месячное исследование эффективности титрования дозы аллопуринола у пациентов с подагрой в рамках стратегии «лечение до цели». РМЖ. 2022;6:17-22.
Rees F, Jenkins W, Doherty M. Patients with gout adhere to curative treatment if informed appropriately: proof-of-concept observational study. Ann Rheum Dis. 2013;72(6):826-830. doi:10.1136/annrheumdis-2012-201676.
Stamp LK, Taylor WJ, Jones PB, et al. Starting dose is a risk factor for allopurinol hypersensitivity syndrome: a proposed safe starting dose of allopurinol. Arthritis Rheum. 2012;64(8):2529-2536. doi:10.1002/art.34488.
Stamp LK,
O’Donnell JL, Zhang M, et al. Using allopurinol above the dose based on
creatinine clearance is effective and safe in patients with chronic gout,
including those with renal impairment. Arthritis Rheum. 2011;63(2):412-421.
Becker MA, Schumacher HR Jr, Wortmann RL, et al. Febuxostat compared with allopurinol in patients with hyperuricemia and gout. N Engl J Med. 2005;353(23):2450- 2461. doi:10.1056/NEJMoa050373.
Becker MA, Schumacher HR Jr, Wortmann RL, et al. Febuxostat, a novel nonpurine selective inhibitor of xanthine oxidase: a twenty-eight-day, multicenter, phase II, randomized, double-blind, placebo-controlled, dose-response clinical trial examining safety and efficacy in patients with gout. Arthritis Rheum. 2005;52(3):916-923. doi:10.1002/art.20935.
Koto R, Nakajima A, Horiuchi H, Yamanaka H. Factors associated with achieving target serum uric acid level and occurrence of gouty arthritis: A retrospective observational study of Japanese health insurance claims data. Pharmacoepidemiol Drug Saf. 2021;30(2):157- 168. doi:10.1002/pds.5127.
Kim YE, Ahn SM, Oh JS, et al. Febuxostat dose requirement according to renal function in patients who achieve target serum urate levels: A retrospective cohort study. Joint Bone Spine. 2024;91(2):105668. doi:10.1016/j.jbspin.2023.105668.
Gao L, Wang B, Pan Y, Lu Y, Cheng R. Cardiovascular safety of febuxostat compared to allopurinol for the treatment of gout: A systematic and meta-analysis. Clin Cardiol. 2021 Jul;44(7):907-916. doi: 10.1002/clc.23643.
Xie H, Hu N, Pan T, et al. Effectiveness and safety of different doses of febuxostat compared with allopurinol in the treatment of hyperuricemia: a meta-analysis of randomized controlled trials. BMC Pharmacol Toxicol. 2023;24(1):79. doi:10.1186/s40360-023-00723- 5.
Чикина МН, Елисеев МС, Желябина ОВ. Практическое применение национальных клинических рекомендаций
по лечению подагры (предварительные данные). Современная ревматология. 2020;
14(2):97-103.
Becker MA, Schumacher HR, MacDonald PA, et al. Clinical efficacy and safety of successful longterm urate lowering with febuxostat or allopurinol in subjects with gout. J Rheumatol. 2009;36(6):1273-1282. doi:10.3899/jrheum.080814.
Tausche AK, Reuss-Borst M, Koch U. Urate lowering therapy with febuxostat in daily practice-a multicentre, open-label, prospective observational study. Int J Rheumatol. 2014;2014:123105. doi:10.1155/2014/123105.
Елисеев МС, Чикина МН, Желябина ОВ. Влияние фебуксостата на вероятность достижения целевого уровня мочевой кислоты в сыворотке крови и почечную функцию у пациентов с подагрой: результаты проспективного наблюдательного исследования. Эффективная фармакотерапия. 2023;19(29):16-21. doi:10.33978/2307- 3586-2023-19-29-16-21.
O'Dell JR, Brophy MT, Pillinger MH, et al. Comparative Effectiveness of Allopurinol and Febuxostat in Gout Management [published correction appears in NEJM Evid. 2022;1(7):EVIDx2200150. doi: 10.1056/EVIDx2200150.] [published correction appears in
NEJM Evid. 2022 Aug;1(8):EVIDx2200180. doi: 10.1056/EVIDx2200180.]. NEJM Evid. 2022;1(3):10.1056/evidoa2100028. doi:10.1056/evidoa2100028
Yang XH,
Zhang BL, Cheng Y, et al. Febuxostat provides renoprotection in patients with
hyperuricemia or gout: a systematic review and meta-analysis of randomized
controlled trials. Ann Med. 2024;56(1):2332956.
Kim SH, Lee SY, Kim JM, Son CN. Renal safety and urate-lowering efficacy of febuxostat in gout patients with stage 4-5 chronic kidney disease not yet on dialysis. Korean J Intern Med. 2020;35(4):998-1003. doi:10.3904/kjim.2018.423.
Kim YE, Ahn SM, Oh JS, et al. Febuxostat dose requirement according to renal function in patients who achieve target serum urate levels: A retrospective cohort study. Joint Bone Spine. 2024;91(2):105668. doi:10.1016/j.jbspin.2023.105668.
Елисеев МС, Желябина ОВ, Чикина МН, Тхакоков ММ. Эффективность фебуксостата у пациентов с подагрой в зависимости
от функции почек. РМЖ. Медицинское обозрение. 2022;6(3):140-147.
Елисеев МС, Чикина МН, Желябина ОВ. Эффективность
фебуксостата у пациентов с умеренным снижением функции почек: результаты
пилотного исследования. Эффективная фармакотерапия. 2024;20(10):6-11.
Lee MKR, Lim YNA. Initiation of Urate Lowering Therapy (ULT). The Singapore Family Physician. 2022;48(1):23-27. doi:10.33591/sfp.49.1.u4.
Qurie A, Preuss CV, Musa R. Allopurinol. In: StatPearls. Treasure Island (FL): StatPearls Publishing; June 26, 2023.
Becker MA, Fitz-Patrick D, Choi HK, et al. An open-label, 6-month study of allopurinol safety in gout: The LASSO study. Semin Arthritis Rheum. 2015;45(2):174-183. doi:10.1016/j.semarthrit.2015.05.005.
de Lautour H, Taylor WJ, Adebajo A, et al. Development of Preliminary Remission Criteria for Gout Using Delphi and 1000Minds Consensus Exercises. Arthritis Care Res (Hoboken). 2016;68(5):667-672. doi:10.1002/acr.22741.
Robinson PC, Dalbeth N, Donovan P. The Cost-effectiveness of Biannual Serum Urate (SU) Monitoring after Reaching Target in Gout: A Health Economic Analysis Comparing SU Monitoring [published correction appears in J Rheumatol. 2019;46(3):330]. J Rheumatol. 2018;45(5):697-704. doi:10.3899/jrheum.170199.
Sutton Burke EM, Kelly TC, Shoales LA, Nagel AK. Angiotensin Receptor Blockers Effect on Serum Uric Acid-A Class Effect?. J Pharm Pract. 2020;33(6):874-881. doi:10.1177/0897190019866315.
Daskalopoulou SS, Tzovaras V, Mikhailidis DP, Elisaf M. Effect on serum uric acid levels of drugs prescribed for indications other than treating hyperuricaemia. Curr Pharm Des. 2005;11(32):4161-4175. doi:10.2174/138161205774913309.
Miao Y, Ottenbros SA, Laverman GD, et al. Effect of a reduction in uric acid on renal outcomes during losartan treatment: a post hoc analysis of the reduction of endpoints in noninsulin-dependent diabetes mellitus with the Angiotensin II Antagonist Losartan Trial. Hypertension. 2011;58(1):2-7. doi:10.1161/HYPERTENSIONAHA.111.171488.
Derosa G, Maffioli P, Sahebkar A. Plasma uric acid concentrations are reduced by fenofibrate: A systematic review and meta-analysis of randomized placebo-controlled trials. Pharmacol Res. 2015;102:63-70. doi:10.1016/j.phrs.2015.09.012.
Hepburn AL, Kaye SA, Feher MD. Long-term remission from gout associated with fenofibrate therapy. Clin Rheumatol. 2003;22(1):73-76. doi:10.1007/s10067-002-0658-1.
Zhao Y, Xu L, Tian D, et al. Effects of sodium-glucose co-transporter 2 (SGLT2) inhibitors on serum uric acid level: A meta-analysis of randomized controlled trials. Diabetes, Obesity and Metabolism. 2017;20(2):458-62. doi:10.1111/dom.13101.
Xin Y, Guo
Y, Li Y, et al. Effects of sodium glucose cotransporter-2 inhibitors on serum
uric acid in type 2 diabetes mellitus: A systematic review with an indirect
comparison metaanalysis. Saudi Journal of Biological Sciences. 2019;26(2):421-6.
Ghukasyan
H, Pedro Navalha DD, Perez Romero I, et al. Reducing hyperuricemic events with
SGLT2 inhibitors: An updated systematic review with meta-regression. Endocrinol
Diabetes Nutr (Engl Ed). 2025;72(1):26-36.
Wang A, Shi W, Zhang N, et al. X. Newer Glucose-Lowering Drugs and Risk of Gout: A Network Meta-Analysis of Randomized Outcomes Trials. Clin Ther. 2024;46(11):851-854. doi:10.1016/j.clinthera.2024.04.013.
Lai SW, Hwang BF, Kuo YH, et al. Sodium-glucose cotransporter-2 inhibitors use and the risk of gout: a systematic review and meta-analysis. Front Endocrinol (Lausanne). 2023;14:1158153. doi:10.3389/fendo.2023.1158153.
Butt JH, Docherty KF, Claggett BL, et al. Association of Dapagliflozin Use With Clinical Outcomes and the Introduction of Uric Acid-Lowering Therapy and Colchicine in Patients With Heart Failure With and Without Gout: A Patient-Level Pooled Meta-analysis of DAPA-HF and DELIVER. JAMA Cardiol. 2023;8(4):386-393. doi:10.1001/jamacardio.2022.5608.
Caulfield MJ, Munroe PB, O’Neill D, et al. SLC2A9 Is a High-Capacity Urate Transporter in Humans. Hattersley A, editor. PLoS Medicine. 2008;5(10):e197. doi:10.1371/journal.pmed.0050197.
Singh JA, Reddy SG, Kundukulam J. Risk factors for gout and prevention: a systematic review of the literature. Curr Opin Rheumatol. 2011;23(2):192-202. doi:10.1097/BOR.0b013e3283438e13.
Hueskes BA, Roovers EA, Mantel-Teeuwisse AK, Janssens HJ, van de Lisdonk EH, Janssen M. Use of diuretics and the risk of gouty arthritis: a systematic review. Semin Arthritis Rheum. 2012;41(6):879-889. doi:10.1016/j.semarthrit.2011.11.008.
Ranieri L, Contero C, Peral ML, et al. Impact of diuretics on the urate lowering therapy in patients with gout: analysis of an inception cohort. Arthritis Res Ther. 2018;20(1):53. doi:10.1186/s13075-018-1559-2.
Zhang P,
Wang H, Chen XH, et al. Effect of low-dose aspirin on serum uric acid levels in
Chinese individuals over 60: subanalysis of a multicentre randomized clinical
trial. Eur Rev Med Pharmacol Sci. 2020;24(5):2719-2724.
Yu J, Qiu Q, Liang L, et al. Prophylaxis of acute flares when initiating febuxostat for chronic gouty arthritis in a real-world clinical setting. Mod Rheumatol. 2018;28(2):339-344. doi:10.1080/14397595.2017.1318467.
Елисеев МС, Чикина МН, Желябина ОВ, Кузьмина ЯИ, Панина ЕВ, Насонов ЕЛ. Эффективность и безопасность длительного приема различных доз колхицина у пациентов с подагрой. Научно-практическая ревматология. 2025;63(2):197-201. doi:10.47360/1995-4484-2025-197-201.
Wortmann RL, Macdonald PA, Hunt B, Jackson RL. Effect of prophylaxis on gout flares
after the initiation of urate-lowering therapy: analysis of data from three
phase III trials. Clin Ther. 2010;32(14):2386-2397.
Huang X, Du
H, Gu J, et al. An allopurinol-controlled, multicenter, randomized,
doubleblind, parallel between-group, comparative study of febuxostat in Chinese
patients with gout and hyperuricemia. Int J Rheum Dis. 2014;17(6):679-686.
Чикина МН, Елисеев МС, Желябина ОВ. Сравнение эффективности и безопасности различных противовоспалительных препаратов при инициации уратснижающей терапии у пациентов с подагрой (предварительные данные). Современная ревматология. 2021;15(2):50-56. doi:10.14412/1996-7012-2021-2-50-56.
Wan H, Zeng L, Xiao R, et al. Colchicine linked with risk reduction for myocardial infarction in gout patients: systematic review and meta-analysis. Z Rheumatol. 2022 Aug;81(6):501-506. English. doi: 10.1007/s00393-022-01232-2.
Siddiqui MU, Junarta J, Sathyanarayanan S, et al. Risk of coronary artery disease in patients with gout on treatment with Colchicine: A systematic review and meta-analysis. Int J Cardiol Heart Vasc. 2023;45:101191. doi: 10.1016/j.ij cha.2023.101191.
Hennessy T,
Soh L, Bowman M, et al. The Low Dose Colchicine after Myocardial Infarction
(LoDoCo-MI) study: A pilot randomized placebo controlled trial of colchicine
following acute myocardial infarction. Am Heart J. 2019;215:62-69.
Nidorf SM, Eikelboom JW, Budgeon CA, Thompson PL. Low-dose colchicine for secondary prevention of cardiovascular disease. J Am Coll Cardiol. 2013;61(4):404-410. doi:10.1016/j.jacc.2012.10.027.
Nidorf SM, Fiolet ATL, Mosterd A, et al. Colchicine in Patients with Chronic Coronary Disease. N Engl J Med. 2020;383(19):1838-1847. doi:10.1056/NEJMoa2021372.
Tardif JC, Kouz S, Waters DD, et al. Efficacy and Safety of Low-Dose Colchicine after Myocardial Infarction. N Engl J Med. 2019;381(26):2497-2505. doi:10.1056/NEJMoa1912388.
Andreis A, Imazio M, Piroli F, et al. Efficacy and safety of colchicine for the prevention of major cardiovascular and cerebrovascular events in patients with coronary artery disease: a systematic review and meta-analysis on 12 869 patients. Eur J Prev Cardiol. 2022;28(17):1916-1925. doi:10.1093/eurjpc/zwab045.
Saseen JJ, Agashivala N, Allen RR, et al. Comparison of patient characteristics and gout- related health-care resource utilization and costs in patients with frequent versus infrequent gouty arthritis attacks. Rheumatology
Насонов ЕЛ, Яхно НН, Каратеев АЕ, и др. Общие принципы лечения скелетномышечной боли: междисциплинарный консенсус. Научно-практическая ревматология. 2016;54(3):247-265. doi:10.14412/1995-4484-2016-247-265.
Елисеев МС, Новикова АМ, Желябина ОВ, и др. Оценка сердечно-сосудистого риска у пациентов с микрокристаллическими артритами и ревматоидным артритом с помощью шкал ATP III и Reynolds Risk Score. Научно-практическая ревматология. 2020;58(5):512-519. doi:10.47360/1995-4484-2020-512-519.
Ly J, Gow P, Dalbeth N. Colchicine prescribing and safety monitoring in patients with gout. N Z Med J. 2007;120(1265):U2808.
Kuncl RW, Duncan G, Watson D, et al. Colchicine myopathy and neuropathy. N Engl J Med. 1987;316(25):1562-1568. doi:10.1056/NEJM198706183162502.
Kuritzky L, Panchal R. Gout: nonsteroidal anti-inflammatory drugs and colchicine to prevent painful flares during early urate-lowering therapy. J Pain Palliat Care Pharmacother. 2010;24(4):397-401. doi:10.3109/15360288.2010.526689.
Singh J., Yang S., Foster J. The risk of aplastic anemia and pancytopenia with colchicine: a retrospective study of integrated health system database. Art. Rheum. 2014;66;(11):20.
Pisaniello HL, Fisher MC, Farquhar H, et al. Efficacy and safety of gout flare prophylaxis and therapy use in people with chronic kidney disease: a Gout, Hyperuricemia and Crystal- Associated Disease Network (G-CAN)-initiated literature review. Arthritis Res Ther. 2021;23(1):130. doi:10.1186/s13075-021-02416-y.
Latourte A, Bardin T, Richette P. Prophylaxis for acute gout flares after initiation of uratelowering therapy. Rheumatology (Oxford). 2014;53(11):1920-1926. doi:10.1093/rheumatology/keu157.
Chen M, Fu W, Xu H, Liu CJ. Pathogenic mechanisms of glucocorticoid-induced osteoporosis. Cytokine Growth Factor Rev. 2023;70:54-66. doi:10.1016/j.cytogfr.2023.03.002.
Ralston SH, Capell HA, Sturrock RD. Alcohol and response to treatment of gout. Br Med J (Clin Res Ed). 1988;296(6637):1641-1642. doi:10.1136/bmj.296.6637.1641-a.
Liu K, Yao Y, Chen W, et al. Modifiable risk factors and incidence of gout: Estimation of population attributable fraction in the US. Semin Arthritis Rheum. 2022;55:152040. doi: 10.1016/j.semarthrit.2022.152040.
Flynn TJ,
Cadzow M, Dalbeth N, et al. Positive association of tomato consumption with
serum urate: support for tomato consumption as an anecdotal trigger of gout
flares. BMC Musculoskelet Disord. 2015;16:196..
Zhang Y, Chen C, Choi H, et al. Purine-rich foods intake and recurrent gout attacks. Ann Rheum Dis. 2012;71(9):1448-1453. doi:10.1136/annrheumdis-2011-201215.
Zhang Y, Chen S, Yuan M, et al. Gout and Diet: A Comprehensive Review of Mechanisms and Management. Nutrients. 2022;14(17):3525. doi: 10.3390/nu14173525.
Li R, Yu K, Li C. Dietary factors and risk of gout and hyperuricemia: a meta-analysis and systematic review. Asia Pac J Clin Nutr. 2018;27(6):1344-1356. doi:10.6133/apjcn.201811_27(6).0022.
Stirpe F, Della Corte E, Bonetti E, et al. Fructose-induced hyperuricaemia. Lancet. 1970;2(7686):1310-1311. doi:10.1016/s0140-6736(70)92269-5.
Zhou J, Wang Y, Lian F, et al. Physical exercises and weight loss in obese patients help to improve uric acid. Oncotarget. 2017;8(55):94893-94899. doi:10.18632/oncotarget.22046.
Nielsen SM, Bartels EM, Henriksen M, et al. Weight loss for overweight and obese individuals with gout: a systematic review of longitudinal studies. Ann Rheum Dis. 2017;76(11):1870-1882. doi:10.1136/annrheumdis-2017-211472.
Дедов ИИ, Шестакова МВ, Мельниченко ГА, и др. Междисциплинарные клинические рекомендации «Лечение ожирения и коморбидных заболеваний». Ожирение и метаболизм. 2021; 18(1):5—99. doi: 10.14341/omet12714.
Chen JH, Wen CP, Wu SB, et al. Attenuating the mortality risk of high serum uric acid: the role of physical activity underused. Ann Rheum Dis. 2015;74(11):2034-2042. doi:10.1136/annrheumdis-2014-205312.
Park DY, Kim YS, Ryu SH, Jin YS. The association between sedentary behavior, physical activity and hyperuricemia. Vasc Health Risk Manag. 2019;15:291-299. doi:10.2147/VHRM.S200278.
Jablonski K, Young NA, Henry C, et al. Physical activity prevents acute inflammation in a gout model by downregulation of TLR2 on circulating neutrophils as well as inhibition of serum CXCL1 and is associated with decreased pain and inflammation in gout patients. PLoS One. 2020;15(10):e0237520. doi:10.1371/journal.pone.0237520.
Carcione J, Bodofsky S, LaMoreaux B, Schlesinger N. Beyond Medical Treatment: Surgical Treatment of Gout. Curr Rheumatol Rep. 2020;23(1):1. doi:10.1007/s11926-020- 00969-6.
Harlianto NI, Harlianto ZN. Patient characteristics, surgical treatment, and outcomes in spinal gout: a systematic review of 315 cases. Eur Spine J. 2023;32(11):3697-3703. doi:10.1007/s00586-023-07942-8.
Poratt D, Rome K. Surgical Management of Gout in the Foot and Ankle A Systematic Review. J Am Podiatr Med Assoc. 2016;106(3):182-188. doi:10.7547/14-128.
Tan YL,
Chen J, Ramalingam MB. Pan-Spinal Cord Compression From Gout: Visual Vignette
of a Young Male Patient With Three Spinal Decompressive Surgeries. Am J Phys
Med Rehabil. 2021;100(4):e58-e59.
Ding Y, Wang W, Jiang W, et al. Tophaceous gout causing thoracic spinal cord compression: Case report and review of the literature. Neurochirurgie. 2018;64(3):171-176. doi:10.1016/j.neuchi.2017.11.002.
Kuo CF, Chou IJ, See LC, et al. Urate-lowering treatment and risk of total joint replacement in patients with gout. Rheumatology (Oxford). 2018;57(12):2129-2139. doi:10.1093/rheumatology/key212.
Teng GG, Leung YY, Ang LW, et al. Gout and risk of knee replacement for severe knee osteoarthritis in the Singapore Chinese Health Study. Osteoarthritis Cartilage. 2017;25(12):1962-1968. doi:10.1016/j.joca.2017.07.017.
Selvadurai D, Coleshill MJ, Day RO, et al. Patient factors and health outcomes associated with illness perceptions in people with gout. Rheumatology (Oxford). 2024;63(7):1927- 1937. doi:10.1093/rheumatology/kead501.
Criscuolo M, Fianchi L, Dragonetti G, Pagano L. Tumor lysis syndrome: review of pathogenesis, risk factors and management of a medical emergency. Expert Rev Hematol. 2016;9(2):197-208. doi:10.1586/17474086.2016.1127156.
Bellos I, Kontzoglou K, Psyrri A, Pergialiotis V. Febuxostat administration for the prevention of tumour lysis syndrome: A meta-analysis. J Clin Pharm Ther. 2019;44(4):525- 533. doi:10.1111/jcpt.12839.
Tamura K, Kawai Y, Kiguchi T, et al. Efficacy and safety of febuxostat for prevention of tumor lysis syndrome in patients with malignant tumors receiving chemotherapy: a phase III, randomized, multi-center trial comparing febuxostat and allopurinol. Int J Clin Oncol. 2016;21(5):996-1003. doi:10.1007/s 10147-016-0971 -3.
Mirrakhimov AE, Voore P, Khan M, Ali AM. Tumor lysis syndrome: A clinical review. World J Crit Care Med. 2015;4(2):130-138. doi:10.5492/wjccm.v4.i2.130.
Cairo MS, Bishop M. Tumour lysis syndrome: new therapeutic strategies and classification. Br J Haematol. 2004;127(1):3-11. doi:10.1111/j.1365-2141.2004.05094.x.
Coiffier B, Altman A, Pui CH, et al. Guidelines for the management of pediatric and adult tumor lysis syndrome: an evidence-based review [published correction appears in J Clin Oncol. 2010 Feb 1;28(4):708]. J Clin Oncol. 2008;26(16):2767-2778. doi:10.1200/JCO.2007.15.0177.
Cohen LF, Balow JE, Magrath IT, et al. Acute tumor lysis syndrome. A review of 37 patients with Burkitt's lymphoma. Am J Med. 1980;68(4):486-491. doi:10.1016/0002- 9343(80)90286-7.
Howren A,
Tsao NW, Choi HK, et al. eHealth-supported decentralized multi-disciplinary
care for gout involving rheumatology, pharmacy, and dietetics: proof-of-concept
study. Clin Rheumatol. 2020;39(4):1241-1249.
Fields TR, Rifaat A, Yee AMF, et al. Pilot study of a multidisciplinary gout patient education and monitoring program. Semin Arthritis Rheum. 2017;46(5):601-608. doi:10.1016/j.semarthrit.2016.10.006.
Edwards NL, Schlesinger N, Clark S, et al. Management of Gout in the United States: A Claims-based Analysis. ACR Open Rheumatol. 2020;2(3):180-187. doi:10.1002/acr2.11121.
Keely E, Rostom K, Smith D, Liddy C. A comparison of faxed referrals and eConsult questions for rheumatology referrals: a descriptive study. CMAJ Open. 2021;9(1):E38-E43. doi:10.9778/cmajo.20200025.
Mikuls TR, Farrar JT, Bilker WB, et al. Suboptimal physician adherence to quality indicators for the management of gout and asymptomatic hyperuricaemia: results from the UK General Practice Research Database (GPRD). Rheumatology (Oxford). 2005;44(8) :1038-1042. doi:10.1093/rheumatology/keh679.
Neogi T, Hunter DJ, Chaisson CE, et al. Frequency and predictors of inappropriate management of recurrent gout attacks in a longitudinal study. J Rheumatol. 2006;33(1):104- 109.
Roddy E, Mallen CD, Hider SL, Jordan KP. Prescription and comorbidity screening following consultation for acute gout in primary care. Rheumatology (Oxford). 2010;49(1):105-111. doi:10.1093/rheumatology/kep332.
Roddy E, Zhang W, Doherty M. Concordance of the management of chronic gout in a UK primary-care population with the EULAR gout recommendations. Ann Rheum Dis. 2007;66(10):1311-1315. doi:10.1136/ard.2007.070755.
Singh JA, Wells GA, Christensen R, et al. Adverse effects of biologics: a network metaanalysis and Cochrane overview. Cochrane Database Syst Rev. 2011;2011(2):CD008794. doi:10.1002/14651858.CD008794.pub2.
Ridker PM, Everett BM, Thuren T, et al. Antiinflammatory Therapy with Canakinumab for Atherosclerotic Disease. N Engl J Med. 2017;377(12):1119-1131.
Yokose C, McCormick N, Chen C, et al. Risk of gout flares after vaccination: a prospective case cross-over study. Ann Rheum Dis. 2019;78(11):1601-1604. doi:10.1136/annrheumdis- 2019-215724.
American Academy of Pediatrics Committee on Drugs. Transfer of drugs and other chemicals into human milk. Pediatrics. 2001;108(3):776-789. doi:10.1542/peds.108.3.776.
Pecoraro V, Trenti T. Predictive value of serum uric acid levels for adverse maternal and perinatal outcomes in pregnant women with high blood pressure. A systematic review and meta-analysis. Eur J Obstet Gynecol Reprod Biol. 2020;252:447-454.
Febuxostat Pregnancy and Breastfeeding Warnings. (Last updated on Feb 12, 2025); (date of treatment: 03.05.2025)
Koopmans
CM, van Pampus MG, Groen H, et al. Accuracy of serum uric acid as a predictive
test for maternal complications in pre-eclampsia: bivariate meta-analysis and
decision analysis. Eur J Obstet Gynecol Reprod Biol. 2009;146(1):8-14.
Simsek M, Opperman RCM, Mulder CJJ, et al. The teratogenicity of allopurinol: A comprehensive review of animal and human studies. Reprod Toxicol. 2018;81:180-187. doi:10.1016/j.reprotox.2018.08.012.
Khanna D, Fitzgerald JD, Khanna PP et al. 2012 American College of Rheumatology guidelines for management of gout. Part 1: systematic nonpharmacologic and pharmacologic therapeutic approaches to hyperuricemia. Arthritis Care Res. 2012;64(10):1431-46. doi: 10.1002/acr.21772.
Khanna D,
Khanna PP, Fitzgerald JD et al. 2012 American College of Rheumatology
guidelines for management of gout. Part 2: therapy and antiinflammatory
prophylaxis of acute gouty arthritis. Arthritis Care Res. 2012;64(10):1447-61.
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
Насонов Евгений Львович — научный руководитель федерального государственного бюджетного научного учреждения «Научно-исследовательский институт ревматологии им. В.А. Насоновой», доктор мед наук, профессор, академик РАН, г. Москва, президент Общероссийской общественной организации «Ассоциация ревматологов России»
Лила Александр Михайлович — директор федерального государственного бюджетного научного учреждения «Научно-исследовательский институт ревматологии им. В.А. Насоновой», заведующий кафедрой ревматологии федерального государственного бюджетного образовательного учреждения дополнительного последипломного образования «Российская медицинская академия непрерывного профессионального образования» Министерства здравоохранения Российской Федерации, доктор мед наук, профессор, член-корреспондент РАН, г. Москва, член Правления и Президиума Общероссийской общественной организации «Ассоциация ревматологов России».
Клименко Алеся Александровна — доцент, заведующая кафедрой факультетской терапии им академика АИ Нестерова ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова», член АРР, член РКО, доктор медицинских наук, врач-терапевт, врач-кардиолог, врач-ревматолог высшей квалификационной категории.
Войтко Дмитрий Алексеевич - старший научный сотрудник отдела мочекаменной болезни НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина - филиал ФГБУ «НМИЦ радиологии» Минздрава России, кандидат медицинских наук, врач-уролог.
Елисеев Максим Сергеевич — старший научный сотрудник, заведующий лабораторией микрокристаллических артритов федерального государственного бюджетного научного учреждения «Научно-исследовательский институт ревматологии им. В.А. Насоновой», кандидат медицинских наук, врач-ревматолог высшей квалификационной категории.
Елисеева Мария Евгеньевна — заведующая отделением Государственного бюджетного учреждения города Москва Геронтологический центр «Левобережный», кандидат медицинских наук, врач-геронтолог, врач-терапевт первой квалификационной категории.
Желябина Ольга Владимировна — младший научный сотрудник лаборатории микрокристаллических артритов Федерального государственного бюджетного научного учреждения «Научно-исследовательский институт ревматологии им. В.А. Насоновой», кандидат медицинских наук, врач-ревматолог.
Кузьмина Янина Игоревна - младший научный сотрудник лаборатории микрокристаллических артритов Федерального государственного бюджетного научного учреждения «Научно-исследовательский институт ревматологии им. В.А. Насоновой», врач-ревматолог.
Мазуров Вадим Иванович — заведующий кафедрой терапии, ревматологии, экспертизы временной нетрудоспособности и качества медицинской помощи им. Э.Э.Эйхвальда федерального государственного бюджетного образовательного учреждения высшего образования «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Министерства здравоохранения Российской Федерации, заведующий научно-исследовательской лаборатории ревматологии федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр имени В. А. Алмазова» Министерства здравоохранения Российской Федерации, доктор медицинских наук, профессор, академик РАН, г. Санкт-Петербург, вице-президент Общероссийской общественной организации «Ассоциация ревматологов России».
Маркелова Евгения Иннокентьевна — старший научный сотрудник ревматологического отделения, доцент кафедры ревматологии ФУВ ГБУЗ МО МОНИКИ им. М.Ф. Владимирского, кандидат медицинских наук, врач-кардиолог, врач функциональной диагностики высшей квалификационной категории.
Немыкин Андрей Александрович — руководитель пациентской организации Медицинского фонда лечения и профилактики подагры «Подагра XXI век», заведующий сектором Ордена Трудового Красного знамени Федерального государственного бюджетного образовательного учреждения высшего образования «Московский технический университет связи и информатики».
Павлова Наталья Николаевна — заведующая кафедрой внутренних болезней педиатрического и стоматологического факультетов Федерального государственного бюджетного образовательного учреждения высшего образования «Читинская государственная медицинская академия» Министерства здравоохранения Российской Федерации, профессор, доктор медицинских наук, врач-кардиолог.
Просянников Михаил Юрьевич - заведующий отделом мочекаменной болезни НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина - ФГБУ «НМИЦ радиологии» Минздрава России, профессор кафедры биомедицинской безопасности МГТУ им. Н.Э. Баумана, доктор медицинский наук, врач-уролог.
Цурко Владимир Викторович — профессор кафедры факультетской терапии лечебного факультета ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» , доктор медицинских наук, врач-терапевт, врач-ревматолог.
Чикина Мария Николаевна — младший научный сотрудник лаборатории
микрокристаллических артритов Федерального государственного бюджетного научного
учреждения «Научно-исследовательский институт ревматологии им. В.А. Насоновой»,
кандидат медицинских наук, врач-ревматолог.
Приложение А2. Методология разработки клинических рекомендаций
Клинические рекомендации по оказанию медицинской помощи пациентам с подагрой составлены в соответствии с требованиями по разработке клинических рекомендаций медицинскими профессиональными некоммерческими организациями, часть 2 статьи 76 Федерального закона от 21.11.2011г. № 323—ФЗ «Об основах охраны здоровья граждан в Российской Федерации», приказом Министерства здравоохранения Российской Федерации №103н от 28.02.2019 г. «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации». Клинические рекомендации основаны на доказательном клиническом опыте, описывающем действия врача, по диагностике, дифференциальной диагностике, лечению, реабилитации и профилактике подагры.
Целевая аудитория данных клинических рекомендаций:
врач-ревматолог;
врач-терапевт.
Медицинским работникам следует придерживаться данных рекомендаций в процессе принятия клинических решений. В то же время рекомендации не заменяют личную ответственность медицинских работников при принятии самостоятельных решений с учетом индивидуальных особенностей клинических проявлений подагры и мнения пациентов. Настоящие рекомендации учитывают накопленный российский и международный опыт курации пациентов с подагрой и базируются на клинических рекомендациях, опубликованных Общероссийской общественной организацией «Ассоциация ревматологов России» [71], ЕУЛАР [44, 82], клинических рекомендациях Американского колледжа ревматологов [147, 333, 334], рекомендациях Французской ассоциации ревматологов.


Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию — не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще одного раза в 6 месяцев.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата

Приложение А3.4. Общая характеристика лекарственных препаратов, применяемых для лечения подагры
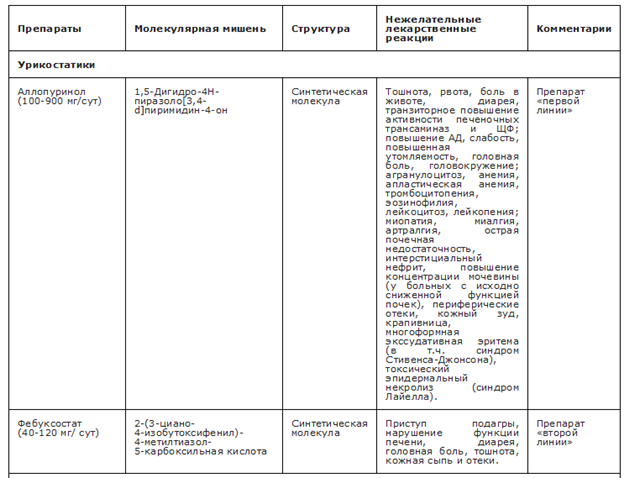
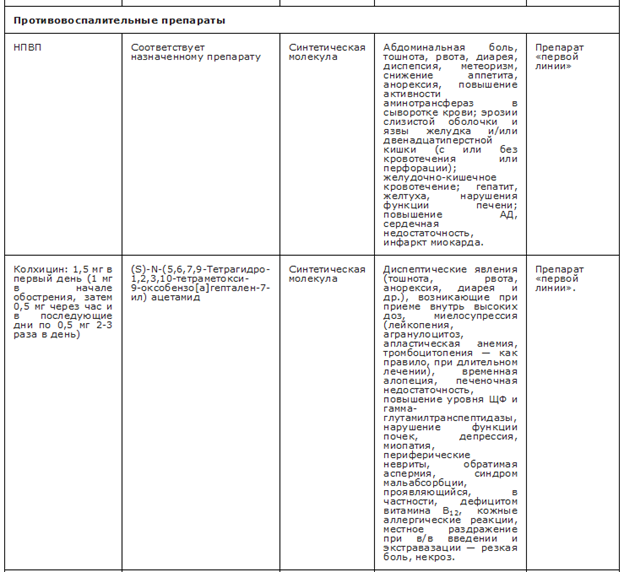
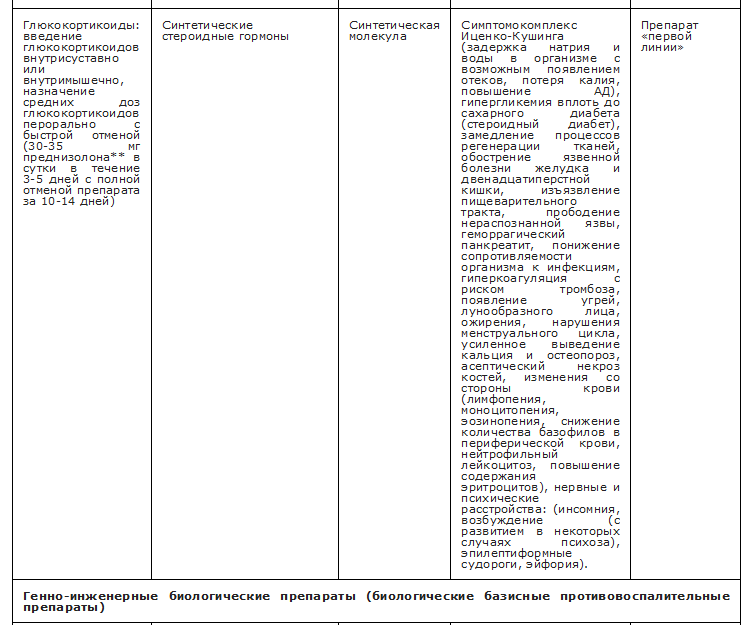
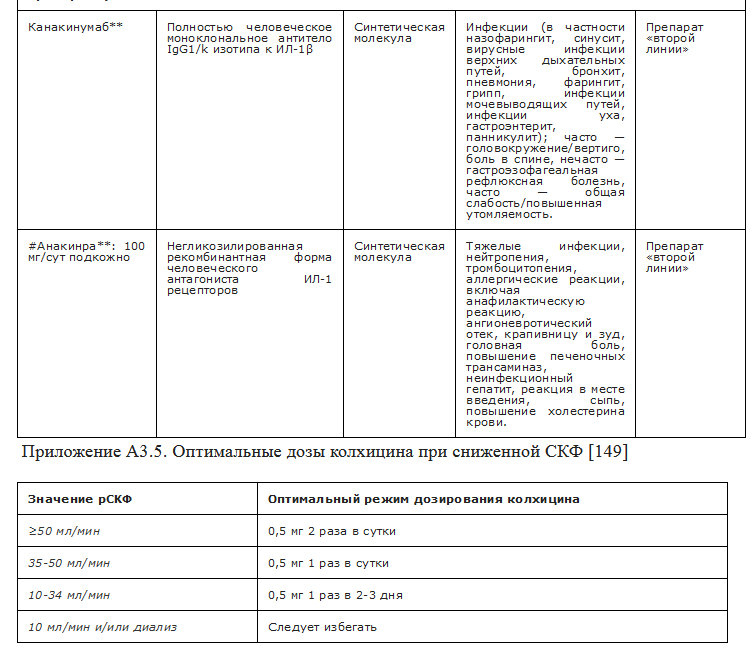
Приложение Б. Алгоритмы ведения пациента
Название подсхемы «Диагностика» блок-схемы «Алгоритм ведения клинических рекомендациях «Подагра»: 1.1 Алгоритм ведения
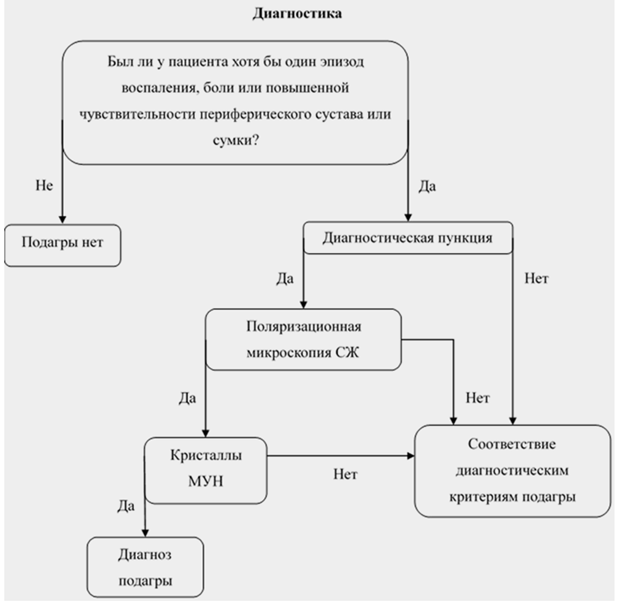
Название подсхемы «Лечение острого артрита» блок-схемы «Алгоритм ведения клинических рекомендациях «Подагра»: 1.2. Алгоритм ведения
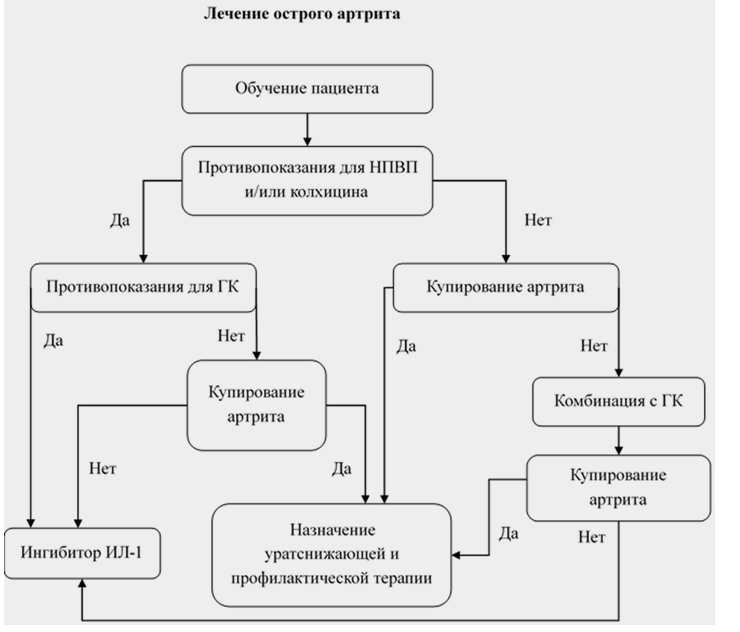
Название подсхемы «Назначение уратснижающей терапии» блок-схемы «Алгоритм ведения клинических рекомендациях «Подагра»: 1.3. Алгоритм ведения
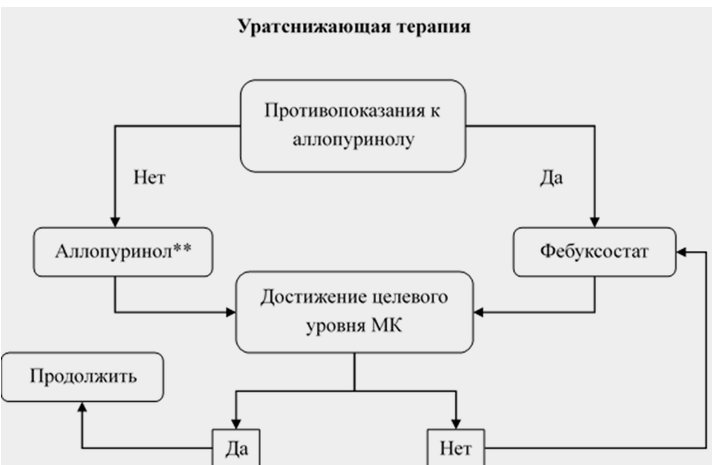
Приложение В. Информация для пациентов
Подагра — болезнь, связанная с воспалением, возникающим в местах отложения солей мочевой кислоты (кристаллов). Последние могут возникать, если в крови много мочевой кислоты (чем её больше, тем выше риск). Но далеко не все лица с высоким уровнем мочевой кислоты заболевают подагрой — только около 20%. Мочевая кислота образуется в организме (примерно 75%) и поступает с пищей (около 25%).
Уровень мочевой кислоты может повышаться из-за множества причин. Часть из них мы не в силах изменить: наследуемая плохая работа каналов, через которые мочевая кислота удаляется почками; возраст; мужской пол. Некоторые факторы можно регулировать: алкоголь, избыточный вес, высокое давление крови, нарушения диеты.
Подагра проявляется приступами сильнейшей боли и воспаления в суставе или нескольких суставах (артрит), чаще в суставах стоп. Сустав увеличивается в объеме, бывает горячим, краснеет. При подозрении на подагру врач может провести исследование жидкости, полученной из сустава, в специальном поляризационном микроскопе.
Лечение назначает врач. Он должен объяснить, что пациент может предпринять самостоятельно при возникновении приступов подагры в дальнейшем. Важно помнить, что если начать лечение рано (в первые часы после развития приступа), эффект будет лучше.
Лечение приступа артрита — это не лечение болезни. Цель — предотвращение подобных приступов и избавление тканей и органов от солей мочевой кислоты, и она достижима почти во всех случаях. Для этого надо стойко снизить уровень мочевой кислоты до уровня, при котором имеющиеся кристаллы рассасываются, а новые — не появляются. Этот «целевой» уровень мочевой кислоты: не выше 360 мкмоль/л (во всех случаях) и 300 мкмоль/л (при тяжелых формах подагры).
Основное лечение подагры — препараты, снижающие уровень мочевой кислоты. Препарат, дозу и схему лечения определяет врач. Диета — важный компонент лечения.
В первые месяцы лечения вероятность приступов возрастает, поэтому вместе с препаратами, снижающими уровень мочевой кислоты, врач может назначить низкие дозы противовоспалительных препаратов или колхицина на ближайшие несколько месяцев.
При длительном поддержании нормального уровня мочевой кислоты постепенно приступы артрита прекратятся, а имеющиеся отложения мочевой кислоты — растворятся.
Лечение подагры проводится постоянно. При его прекращении вновь будут образовываться кристаллы и возникать приступы. Отсутствие адекватного лечения может привести к разрушению суставов, тканей и, как следствие, к инвалидизации и поражению различных органов (например, тяжелым болезням почек).
Приложение ri-rN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Приложение Г1. Классификационные критерии подагры Американской коллегии ревматологов (АКР)/Европейского альянса ассоциаций ревматолгов (ЕУЛАР).
Название на русском языке: Классификационные критерии подагры Американской коллегии ревматологов (АКР)/Европейского альянса ассоциаций ревматологов (ЕУЛАР). Оригинальное название (если есть): ACR-EULAR Gout Classification Criteria Источник (официальный сайт разработчиков, публикация с валидацией): 2015 Gout classification criteria: an American College og Rheumatology/European League Against Rhematism collaborative initiative. Neogi T, Jansen TLTA, Dalbeth N, et al. Ann Rheum Dis 2015;74:1789-1798/
Тип (подчеркнуть):
шкала оценки
индекс
вопросник
другое (уточнить): классификационные критерии Назначение: верификация диагноза подагры
Содержание (шаблон):
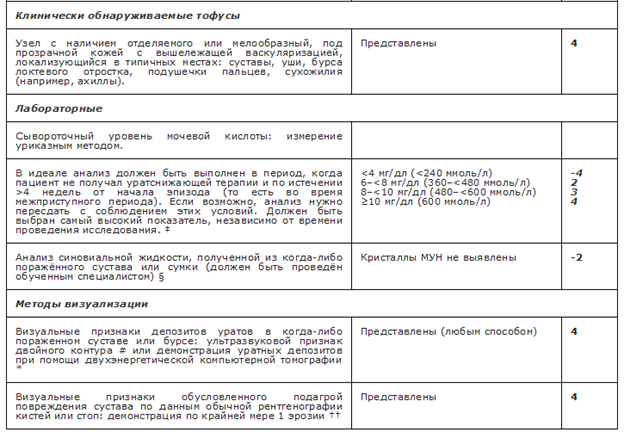

f - Эпизоды бывших когда-либо симптомов, которые включают припухлость, боль, болезненность при пальпации в периферическом суставе или бурсе.
J - Если сывороточный уровень МК <4 мг/дл (240 мкмоль/л), следует вычесть 4 балла; если сывороточный уровень мочевой кислоты >4 мг/дл - 6 мг/дл (>240 - <360 мкмоль/л), считать этот пункт как 0 баллов.
§ - Если проведенная обученным специалистом поляризационная микроскопия синовиальной жидкости, полученной из когда-либо пораженного сустава, не выявила кристаллов моноурата натрия, следует вычесть 2 балла. Если синовиальная жидкость не была оценена, считать этот пункт как 0 баллов.
^ - Если методы недоступны, считать этот пункт как 0 баллов.
# - Гиперэхогенная прерывистая полоска по поверхности гиалинового хряща, независящая от угла осмотра (примечание: ложноположительный признак двойного контура может появиться на поверхности хряща, но должен исчезнуть при изменении угла осмотра).
* - Наличие соответствующих цвету кодировки уратов в области суставов или периартикулярно. Изображения должны быть получены с помощью двухэнергетической компьютерной томографии, данные получены при 80 и 140 kV и проанализированы с использованием подагра-специфичного программного обеспечение с двухтканевой декомпозицией цветового кодирования уратов. Положительный результат сканирования определяется при наличии цветовой кодировки урата в суставных или околосуставных участках. Ногтевое ложе, микроволны, кожа, движение, увеличение жесткости излучения и сосудистые артефакты не должны быть интерпретированы как доказательства
наличия уратных депозитов методом двухэнергетической компьютерной томографии.
ff - Эрозия определена как кортикальный дефект со склеротической каймой и нависающими краями, исключая дистальные межфаланговые суставы и признак «крыла чайки».
Ключ (интерпретация):
Диагноз подагры устанавливается либо при визуальном обнаружении кристаллов МУН в СЖ или содержимом тофуса, либо при наличии совокупности клинических, лабораторных и инструментальных признаков заболевания, рассчитываемых в баллах. Согласно критериям, если баллов 8 и более, заболевание может быть классифицировано как подагра.
Название на русском языке: Визуальная аналоговая шкала боли (ВАШ) Оригинальное название (если есть): A Visual Analogue Scale - VAS Источник (официальный сайт разработчиков, публикация с валидацией): Gelinas C, Puntillo KA, Levin P, et al: The Behavior Pain Assessment Tool for critically ill adults: A validation study in 28 countries. Pain 2017; 158:811-821.
Тип (подчеркнуть):
шкала оценки
индекс
- вопросник
- другое (уточнить):
Назначение: оценка интенсивности боли Содержание (шаблон):
Визуально-аналоговая шкала (ВАШ) интенсивности боли
Ключ (интерпретация):
0 баллов - нет нарушений;
1-3 балла - легкая боль (легкие нарушения);
4-6 баллов - умеренная боль (умеренные нарушения);
7-8 баллов - выраженная боль (тяжелые нарушения);
9-10 баллов - невыносимая боль (абсолютные нарушения).
Теги: подагра
234567 Начало активности (дата): 22.08.2025
234567 Кем создан (ID): 989
234567 Ключевые слова: подагра, кристаллы моноурата натрия, медицинское вмешательство, мочевая кислота, острый артрит
12354567899
Похожие статьи
Стенозирующий лигаментит пальцев кистиРентген на дому 8 495 22 555 6 8
Остеопороз
Острый артрит, ассоциированный с COVID-19
Лечение хронических болей и триггерных зон в ортопедии и неврологии методом ударно-волновой терапии аппаратом DORNIER ARIES



