 08.09.2025
08.09.2025
Остеоартрит: нюансы базисной терапии
Остеоартрит (ОА) является наиболее распространенным заболеванием суставов и частой причиной ограничения физической активности и снижения качества жизни у взрослых.
Введение
Остеоартрит (ОА) — широко распространенное заболевание суставов, которым страдают более 7% людей разного возраста во всем мире [1]. Долгое время считалось, что к развитию ОА приводит деградация и «изнашивание» суставного хряща [2]. В настоящее время ОА рассматривается как сложный патофизиологический процесс, характеризующийся клеточным стрессом и деградацией экстрацеллюлярного матрикса, возникающими при макро- и микроповреждениях суставов, которые активируют ненормальные адаптивные восстановительные ответы, воспалительные пути иммунной системы [3].
Около 240 млн человек страдают клинически выраженным ОА, как правило, с вовлечением в патологический процесс двух и более суставов
Прогнозируется, что заболеваемость и распространенность ОА, которые и так уже высоки, резко возрастут в ближайшие десятилетия из-за старения населения, роста показателей ожирения и высокого уровня травматических повреждений суставов [5, 6]. По данным A. Turkiewicz et al. [7], общая распространенность ОА (кроме ОА позвоночника) составила 26,6% в Швеции в 2012 г. В другом исследовании, проведенном в Нидерландах, сообщалось, что распространенность ОА составляла 7% в 2015 г., но может возрасти до 12% к 2040 г. [8]. Таким образом, существует тенденция к росту распространенности ОА, что обусловливает необходимость совершенствования подходов к его диагностике и лечению.
Остеоартрит на современном этапе
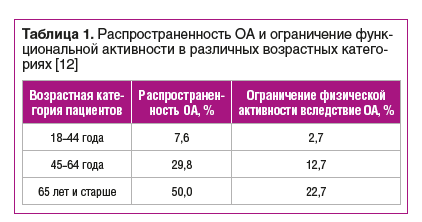
В определении OARSI (Международное общество по изучению ОА) указано: «Первоначально происходят нарушения на молекулярном уровне (ненормальный метаболизм в тканях сустава) с последующими анатомическими и физиологическими нарушениями (деградация хряща, ремоделирование кости, образование остеофитов, воспаление, потеря нормальной функции сустава), приводящими к развитию заболевания» [9]. Отмечается тенденция к «омоложению» возраста дебюта ОА. Почти 30% лиц 45 лет и старше имеют рентгенологические признаки ОА коленного сустава, примерно у половины из них клинически выраженная форма поражения коленного сустава, а распространенность симптомного рентгенологического ОА тазобедренного сустава составляет около 10% (табл. 1) [10–12]. К факторам риска ОА относятся пожилой возраст (особенно старше 50 лет), женский пол, избыточная масса тела / ожирение, перенесенная травма сустава, работа, требующая длительного наклона или сидения на корточках, семейный анамнез, участие в видах спорта, связанных с повторяющимися ударами (например, футбол) [13].
Риск симптомного ОА коленного сустава выше у лиц с ожирением (индекс массы тела (ИМТ) ≥30 кг/м2), чем у людей без ожирения (19,7% против 10,9%) [14]. Предшествующая травма сустава, такая как разрыв передней крестообразной связки и перелом лодыжки, увеличивает риск и составляет 12% случаев ОА коленного сустава [9]. По сравнению с мужчинами с ОА женщины имеют более тяжелые рентгенологические признаки и симптомы ОА.
Кроме того, врожденные и приобретенные анатомические аномалии (например, дисплазия тазобедренного сустава) являются факторами риска ОА тазобедренного сустава, часто осложняющегося асептическим некрозом головки бедренной кости [15]. Среди представителей негроидной расы и европеоидной расы отмечается одинаковая распространенность ОА тазобедренного сустава (с учетом расы, пола и ИМТ), в то время как среди представителей негроидной расы, особенно женщин, больше распространен ОА коленного сустава [5, 7].
Также необходимо отметить, что 78% пациентов с ОА коленного сустава имеют коморбидность по другим мышечно-скелетным заболеваниям и 82% — коморбидность по заболеваниям внутренних органов [16]. В исследовании [17] на основании анализа данных 42 рандомизированных клинических исследований показано, что у 29% пациентов была одна сопутствующая патология, у 25% — две, а у 24% — три и более. Ведущими хроническими состояниями, зарегистрированными среди лиц с ОА, были артериальная гипертензия (50%), дислипидемия (48%) и боль в спине (33%). Большая распространенность сопутствующей патологии вносит серьезный вклад в процессы, приводящие к развитию поражения суставов, а также в формирование клинической картины ОА.
Необходимо подчеркнуть, что имеются обширные данные, подтверждающие, что ожирение является одним из основных факторов риска ОА коленного сустава [18], независимо от используемого метода оценки [19]. Сообщений, связывающих ожирение с ОА кистей [20], зафиксировано меньше, и более противоречивые результаты получены в отношении ОА тазобедренного сустава [21]. Механическая перегрузка несущего вес сустава или активация метаболических факторов, способствующих повреждению сустава, были названы в качестве возможных механизмов, объясняющих, как вес увеличивает риск ОА коленного сустава или суставов кисти [22].
Распространенность избыточной массы тела и ожирения во всем мире с 1980 г. увеличилась до такой степени, что почти треть населения мира в настоящее время классифицируется как страдающая ожирением [23]. Показатели ожирения увеличились для всех возрастов и обоих полов, независимо от географического положения, социально-экономического статуса или этнической принадлежности, хотя распространенность ожирения, как правило, выше среди лиц пожилого возраста и женщин. Изучение влияния избыточной массы тела на развитие ОА, роль адипокинов в поддержании хронического воспаления в суставах, прямая взаимосвязь инсулинорезистентности и синовиального воспаления, роль окисленных липопротеинов низкой плотности в формировании очагов жирового повреждения кости и поддержании воспаления синовиальной оболочки, роль микробиоты кишечника в поддержании иммунного воспаления, низкая физическая активность, а также высокая смертность пациентов с ОА и метаболическим синдромом (МС) от сердечно-сосудистых событий позволили сформировать метаболический фенотип заболевания, который наиболее часто ассоциируется с наличием большого количества сопутствующих заболеваний у пациента и требует особого подхода к выбору медикаментозной базисной терапии ОА.
Основные клинические рекомендации по лечению ОА
В последние годы клинические рекомендации по лечению ОА обновили ESCEO (Европейское общество по клиническим и экономическим аспектам остеопороза, остеоартрита и мышечно-скелетных заболеваний) в 2016 г., EULAR (Европейская антиревматическая лига) в 2018 г., OARSI в 2019 г., Ассоциация ревматологов России в 2017 и 2021 гг. и др. [9, 24–27].
Все современные руководящие документы по ОА определяют цели лечения: уменьшение боли; сохранение или улучшение функции суставов; предотвращение нарастания функциональной недостаточности; улучшение качества жизни, связанного со здоровьем; предупреждение и сокращение нежелательных явлений от фармакотерапии.
Cимптоматические препараты замедленного действия для лечения ОА (SYSADOA) представляют собой важный класс фармакологических средств лечения ОА, которые, как было показано, облегчают симптомы боли и функциональных нарушений с некоторыми дополнительными доказательствами модифицирующего эффекта течения заболевания в долгосрочной перспективе [28]. Класс SYSADOA включает множество различных лекарственных средств, в том числе глюкозамин, хондроитин, диацереин и неомыляемые соединения авокадо/сои, клиническая эффективность которых подтверждается различными данными. Метаанализ плацебо-контролируемых исследований лечения SYSADOA продолжительностью до 3 лет свидетельствует о том, что рецептурные глюкозамина сульфат (ГС), хондроитина сульфат (ХС) и диацереин оказывают небольшое или умеренное положительное воздействие на течение ОА [29, 30].
Группа SYSADOA обладает общими чертами, позволяющими рекомендовать их в качестве базисной терапии ОА. На основании многих указанных рекомендаций в качестве первого шага всем пациентам с ОА рекомендуется на длительный срок назначать ХС и/или кристаллический ГС, а также препараты из группы диацереина и неомыляемых соединений авокадо и сои, биоактивный концентрат из мелкой морской рыбы, гликозамингликан-пептидный комплекс [9, 24–26].
Наиболее изучены такие препараты, как ХС и ГС. Их анальгетический эффект превосходит плацебо и сопоставим с действием нестероидных противовоспалительных препаратов (НПВП), но клиническое действие наступает через 2–3 мес. [25, 27]. Основные преимущества препаратов из группы SYSADOA — это их безопасность, сопоставимая с безопасностью плацебо, возможность постепенного снижения или даже полной отмены НПВП.
При этом оценки эффективности, доказательности влияния на стимуляцию роста хондроцитов, купирование боли, подавление воспаления значимо изменяются от года к году по мере появления новых результатов клинических исследований. Практическое же применение препаратов SYSADOA требует серьезного анализа сопутствующих заболеваний у конкретного пациента.
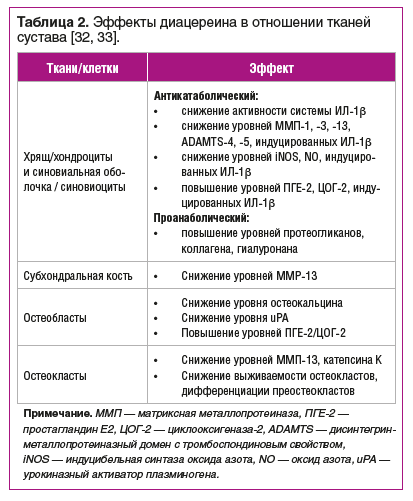
Еще одним препаратом из группы SYSADOA, обладающим как симптом-, так и структурно-модифицирующим действием, является диацереин (Диартрин), который представляет собой производное антрахинона. Основной механизм действия диацереина и его активных метаболитов (реина) связан с ингибированием интерлейкина 1β (ИЛ-1β) и нисходящих сигнальных путей, которые, согласно исследованиям на животных моделях, играют ключевую роль в патогенезе ОА [31]. Диацереин обладает уникальными фармакологическими и биологическими свойствами, включая противовоспалительные, антикатаболические и проанаболические свойства в отношении как хрящевой ткани, так и синовиальной оболочки, а также оказывает протективное воздействие на субхондральную кость (табл. 2) [32, 33].
В метаанализе 19 опубликованных и неопубликованных исследований, включающих в общей сложности более 2600 пациентов с ОА, B. Rintelen et al. [34] продемонстрировали значимое превосходство диацереина по сравнению с плацебо в отношении улучшения симптомов ОА (уменьшение боли и улучшение функции сустава), а также сопоставимую эффективность диацереина и НПВП. Однако при этом, в отличие от НПВП, диацереин обладал выраженным последействием после завершения периода лечения и не вызывал серьезных побочных эффектов. Еще в одном метаанализе 6 рандомизированных плацебо-контролируемых исследований было показано, что диацереин может быть альтернативой терапии у больных ОА, которые не могут принимать парацетамол или НПВП [29].
На основании данных метаанализов и обзора публикаций о клинических исследованиях ESCEO в 2016 г. подтвердило, что эффективность диацереина уже после 1-го месяца лечения сопоставима с эффективностью НПВП и превышает эффективность парацетамола. Также было показано, что препарат имеет пролонгированное действие в отношении ОА в течение нескольких месяцев даже после завершения периода лечения [31]. Кроме того, в 2020 г. были представлены результаты клинического исследования фазы III (NCT02688400), в котором авторы изучали сравнительную эффективность и безопасность применения в течение 6 мес. диацереина (50 мг 1 р/сут в течение 1 мес. и 2 р/сут далее (n=187)) по сравнению с целекоксибом (200 мг 1 р/сут (n=193)) у пациентов с ОА коленного сустава средней и тяжелой степени, согласно которым диацереин не уступал целекоксибу в уменьшении боли, скованности или функциональных ограничений [35].
M. Permuy et al. [36] на животных моделях индуцированного ОА показали, что применение диацереина в течение 8 нед. способствует менее выраженным изменениям синовиальной оболочки (выраженность воспаления, гиперплазии и степень ее инфильтрации воспалительными клетками) по данным гистологического исследования по сравнению с группой плацебо.
Изучая структурно-модифицирующее действие диацереина у пациентов с первичным ОА тазобедренного сустава, М. Dougados et al. [37] продемонстрировали статистически значимое замедление рентгенологического прогрессирования в течение 3-летнего периода лечения. Кроме этого, было установлено, что частота эндопротезирования тазобедренного сустава в группе пациентов, получавших диацереин, была ниже по сравнению с пациентами из группы плацебо в течение всего периода терапии и в последующие 3 мес. после завершения лечения (14,5% и 19,8% соответственно).
Кроме симптом- и структурно-модифицирующего действия, в многочисленных международных и отечественных исследованиях были продемонстрированы другие многообещающие фармакологические эффекты диацереина [33, 38]. Он обладает доказанными положительными метаболическими эффектами, что особенно важно для пациентов с МС, сахарным диабетом (СД) 2 типа и сопутствующими сердечно-сосудистыми заболеваниями (ССЗ).
Диацереин не оказывает негативного влияния на сывороточный уровень глюкозы, а наоборот, в нескольких клинических исследованиях доказал положительное воздействие на снижение уровня глюкозы и гликированного гемоглобина [39, 40].
В отличие от НПВП диацереин не обладает негативным действием на почечную функцию [41], которая и так подвергается отрицательным влияниям у пациента с ССЗ (артериальная гипертония) и МС / СД [42, 43]. Вопрос сохранности функции почек у пациента с МС / СД и ССЗ на фоне ОА приобретает особое значение с точки зрения сохранения качества жизни пациента, а также противодействия сокращению продолжительности жизни. Длительный прием НПВП в современной медицине расценивается как один из важнейших факторов развития сердечно-сосудистых катастроф и повышения риска связанной с ними смертности [44].
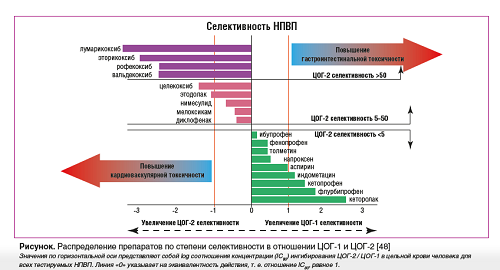
В соответствии с клиническими рекомендациями по ведению больных ОА с коморбидностью [45] и по рациональному использованию НПВП [46] у пациентов с уже установленными ССЗ (инфаркт миокарда, острый коронарный синдром, реваскуляризация коронарных и других артерий, острое нарушение мозгового кровообращения и др.), а также получающих антикоагулянтную или двойную антиагрегантную терапию существенно ограничено применение НПВП для контроля болевого синдрома. Также сложен выбор анальгетической терапии при ОА для пациентов с умеренным и высоким риском сердечно-сосудистых и гастроинтестинальных осложнений терапии НПВП [47] (см. рисунок).
Сокращение длительности курсов НПВП у пациентов с ОА (как с сопутствующей патологией, так и без нее) может быть частично осуществлено при помощи назначения диацереина (Диартрин) в качестве базисной терапии ОА, в особенности у пациентов с метаболическим фенотипом заболевания.
Проведенный Л.Н. Елисеевой и соавт. [49] ретроспективный анализ эффективности и безопасности применения диацереина в течение 4 мес. у 28 пациентов с гонартрозом и 25 пациентов с коксартрозом III–IV рентгенологической стадии, уже включенных в лист ожидания для тотального эндопротезирования, продемонстрировал не только снижение выраженности болевого синдрома по визуальной аналоговой шкале (уменьшение с 68,3±11,3 мм до 56,0±10,2 мм у пациентов с коксартрозом и с 70,6±8,8 мм до 42,1±9,3 мм у больных с гонартрозом), но и сокращение потребности в применении НПВП (с 92,0% до 64,0% и с 92,86% до 85,71% соответственно). Кроме того, 28% пациентов с коксартрозом и 7,15% пациентов с гонартрозом удалось полностью прекратить прием НПВП. Важно отметить, что при оценке гликемии и уровня креатинина с расчетом скорости клубочковой фильтрации изменений на фоне терапии диацереином выявлено не было.
Заключение
Таким образом, ОА — широко распространенное заболевание, приводящее к инвалидизации пациента. Физические упражнения и снижение веса, четкое выполнение алгоритма выбора базисных препаратов при ОА с учетом коморбидности больного являются краеугольным камнем лечения. Одним из препаратов группы SYSADOA, обладающим не только симптом- и структурно-модифицирующим действием, но и благоприятным профилем безопасности у пациентов с ССЗ, СД 2 типа, МС, является диацереин. Уменьшение болевого синдрома и улучшение функции суставов, проявляющиеся уже через 2–4 нед. от начала терапии диацереином (Диартрин) и сохраняющиеся в течение 1–3 мес. после прекращения его применения, делают данный препарат привлекательным с точки зрения соотношения пользы и риска.
Литература
1. Leifer V.P., Katz J.N., Losina E. The burden of OA-health services and economics. Osteoarthritis Cartilage 2022;30(1):10–16. DOI: 10.1016/j.joca.2021.05.007.
2. Glyn-Jones S., Palmer A.J.R., Agricola R. et al. Osteoarthritis. Lancet. 2015;386:376–387. DOI: 10.1016/S0140-6736(14)60802-3.
3. Primorac D., Molnar V., Rod E. et al. Knee Osteoarthritis: A Review of Pathogenesis and State-Of-The-Art Non-Operative Therapeutic Considerations. Genes (Basel). 2020;11(8):854. DOI: 10.3390/genes11080854.
4. Hawker G.A. Osteoarthritis is a serious disease. Clin Exp Rheumatol. 2019;37 Suppl 120(5):3–6.
5. Mandl L.A. Osteoarthritis year in review 2018: clinical. Osteoarthritis Cartilage. 2019;27(3):359–364. DOI: 10.1016/j.joca.2018.11.001.
6. Ogden C.L., Carroll M.D., Lawman H.G. et al. Trends in obesity prevalence among children and adolescents in the United States, 1988–1994 through 2013–2014. JAMA. 2016;7(315):2292–2299. DOI: 10.1001/jama.2016.6361.
7. Turkiewicz A., Petersson I.F., Björk J. et al. Current and future impact of osteoarthritis on health care: a population-based study with projections to year 2032. Osteoarthritis Cartilage. 2014;22(11):1826–1832. DOI: 10.1016/j.joca.2014.07.015.
8. National Institute of public health and the Environment. Ministry of health, welfare and sport. Public Health Foresight Study 2018 (VTV-2018): diseases A healthy prospect Synthesis. (Electronic resource.)
9. Arden N.K., Perry T.A., Bannuru R.R. et al. Non-surgical management of knee osteoarthritis: comparison of ESCEO and OARSI 2019 guidelines. Nat Rev Rheumatol. 2021;17(1):59–66. DOI: 10.1038/s41584-020-00523-9.
10. Jordan J.M., Helmick C.G., Renner J.B. et al. Prevalence of knee symptoms and radiographic and symptomatic knee osteoarthritis in African Americans and Caucasians: the Johnston County Osteoarthritis Project. J Rheumatol. 2007;34(1):172–180.
11. Haugen I.K., Englund M., Aliabadi P. et al. Prevalence, incidence and progression of hand osteoarthritis in the general population: the Framingham Osteoarthritis Study. Ann Rheum Dis. 2011;70(9):1581–1586. DOI: 10.1136/ard.2011.150078.
12. Centers for Disease Control and Prevention (CDC). Prevalence of doctor-diagnosed arthritis and arthritis-attributable activity limitation — United States, 2007–2009. MMWR Morb Mortal Wkly Rep. 2010;59(39):1261–1265.
13. Zhang W., Doherty M., Peat G. et al. EULAR evidence-based recommendations for the diagnosis of knee osteoarthritis. Ann Rheum Dis. 2010;69(3):483–489. DOI: 10.1136/ard.2009.113100.
14. Losina E., Weinstein A.M., Reichmann W.M., et al. Lifetime risk and age at diagnosis of symptomatic knee osteoarthritis in the US. Arthritis Care Res (Hoboken). 2013;65(5):703–711. DOI: 10.1002/acr.21898.
15. Шостак Н.А., Клименко А.А., Николенко М.В. Остеоартроз: вопросы патогенеза и лечение. Клиницист. 2010;1:47–53. [Shostak N.A., Klimenko A.A., Nikolenko M.V. Osteorthritis: issues of pathogenesis and treatment. Klinitsist. 2010;1:47–53 (in Russ.)].
16. Chan K.W., Ngai H.Y., Ip K.K. et al. Comorbidities of patients with knee osteoarthritis. Hong Kong Med J. 2009;15(3):168–172.
17. Swain S., Sarmanova A., Coupland C. et al. Comorbidities in Osteoarthritis: A systematic review and meta‐analysis of observational studies. Arthritis Care Res. 2020;72(7):991–1000. DOI: 10.1002/acr.24008.
18. Grotle M., Hagen K.B., Natvig B. et al. Obesity and osteoarthritis in knee, hip and/or hand: an epidemiological study in the general population with 10 years follow-up. BMC Musculoskelet Disord. 2008;9:132. DOI: 10.1186/1471-2474-9-132.
19. Lohmander L.S., Gerhardsson de Verdier M., Rollof J. et al. Incidence of severe knee and hip osteoarthritis in relation to different measures of body mass: a population-based prospective cohort study. Ann Rheum Dis. 2009;68(4):490–496. DOI: 10.1136/ard.2008.089748.
20. Yusuf E., Nelissen R.G., Ioan-Facsinay A. et al. Association between weight or body mass index and hand osteoarthritis: a systematic review. Ann Rheum Dis. 2010;69(4):761–765. DOI: 10.1136/ard.2008.106930.
21. Reijman M., Pols H.A., Bergink A.P. et al. Body mass index associated with onset and progression of osteoarthritis of the knee but not of the hip: the Rotterdam Study. Ann Rheum Dis. 2007;66(2):158–162. DOI: 10.1136/ard.2006.053538.
22. King L.K., March L., Anandacoomarasamy A. Obesity & osteoarthritis. Indian J Med Res. 2013;138(2):185–193.
23. Chooi Y.C., Ding C., Magkos F. The epidemiology of obesity. Metabolism. 2019;92:6–10. DOI: 10.1016/j.metabol.2018.09.005.
24. Kroon F.P.B., Carmona L., Schoones J.W., Kloppenburg M. Efficacy and safety of non-pharmacological, pharmacological and surgical treatment for hand osteoarthritis: a systematic literature review informing the 2018 update of the EULAR recommendations for the management of hand osteoarthritis. RMD Open. 2018;4(2):e000734. DOI: 10.1136/rmdopen-2018-000734.
25. Bruyère O., Cooper C., Pelletier J.P. et al. A consensus statement on the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO) algorithm for the management of knee osteoarthritis-From evidence-based medicine to the real-life setting. Semin Arthritis Rheum. 2016;45(4):S3–11. DOI: 10.1016/j.semarthrit.2015.11.010.
26. Гонартроз. Клинические рекомендации. 03.09.2021. Утверждены Минздравом РФ. [Gonarthrosis. Clinical guidelines. 09/03/2021. Approved by the Ministry of Health of the Russian Federation (in Russ.)].
27. Лила А.М., Алексеева Л.И., Таскина Е.А. Современные подходы к терапии остеоартрита с учетом обновленных международных рекомендаций. РМЖ. Медицинское обозрение 2019;3(11–2):48–52 [Lila A.M., Alekseeva L.I., Taskina E.A. Modern approaches to osteoarthritis therapy taking into account updated international guidelines. RMJ. Medical Review. 2019;11(II):48–52 (in Russ.)]. 28. Singh J.A., Noorbaloochi S., MacDonald R., Maxwell L.J. Chondroitin for osteoarthritis. Cochrane Database Syst Rev. 2015;1(1):CD005614. DOI: 10.1002/14651858.cd005614.pub2.
29. Bartels E.M., Bliddal H., Schondorff P.K. et al. Symptomatic efficacy and safety of diacerein in the treatment of osteoarthritis: a meta-analysis of randomized placebo-controlled trials. Osteoarthritis Cartilage. 2010;18(3):289–296. DOI: 10.1016/j.joca.2009.10.006.
30. Hochberg M.C. Structure-modifying effects of chondroitin sulfate in knee osteoarthritis: an updated meta-analysis of randomized placebo-controlled trials of 2-year duration. Osteoarthritis Cartilage. 2010;18(1):S28–S31. DOI: 10.1016/j.joca.2010.02.016.
31. Pavelka K., Bruyère O., Cooper C. et al. Diacerein: benefits, risks and place in the management of osteoarthritis. An opinion-based report from the ESCEO. Drugs Aging. 2016;33(2):75–85. DOI: 10.1007/s40266-016-0347-4.
32. Martel-Pelletier J., Pelletier J. P. Effects of diacerein at the molecular level in the osteoarthritis disease process. Ther Adv Musculoskelet Dis. 2010;2(2):95–104. DOI: 10.1177/1759720X09359104.
33. Almezgagi M., Zhang Y., Hezam K. et al. Diacerein: recent insight into pharmacological activities and molecular pathways. Biomed Pharmacother. 2020;131:110594. DOI: 10.1016/j.biopha.2020.110594.
34. Rintelen B., Neumann K., Leeb B.F. A meta-analysis of controlled clinical studies with diacerein in the treatment of osteoarthritis. Arch Intern Med. 2006;166(17):1899–1906. DOI: 10.1001/archinte.166.17.1899.
35. Pelletier J.P., Raynauld J.P., Dorais M. et al. An international, multicentre, double-blind, randomized study (DISSCO): effect of diacerein vs celecoxib on symptoms in knee osteoarthritis. Rheumatology (Oxford). 2020;59(12):3858–3868. DOI: 10.1093/rheumatology/keaa072.
36. Permuy M., Guede D., López-Peña D. et al. Effects of diacerein on cartilage and subchondral bone in early stages of osteoarthritis in a rabbit model. BMC Vet Res. 2015;11:143. DOI: 10.1186/s12917-015-0458-x.
37. Dougados M., Nguyen M., Berdah L. et al. Evaluation of the structure-modifying effects of Diacerhein in hip osteoarthritis. ECHODIAN, a three-year-placebo-controlled trial. Arthritis Rheum. 2001;44(11):2539–2547. DOI: 10.1002/1529-0131(200111)44:11<2539::aid-art434>3.0.co;2-t.
38. Алексеева Л.И., Таскина Е.А., Кашеварова Н.Г. и др. Остеоартрит коленных суставов и метаболический синдром: новые подходы к терапии. Научно-практическая ревматология. 2018;56(2):157–163. [Alekseeva L.I., Taskina E.A., Kashevarova N.G. et al. Knee osteoarthritis and metabolic syndrome: new approaches to therapy. Rheumatology Science and Practice. 2018;56(2):157–163 (in Russ.)]. DOI: 10.14412/1995-4484-2018-157-163.
39. Martorell M., Castro N., Victoriano M. et al. An update of anthraquinone derivatives emodin, diacerein, and catenarin in diabetes. Evid Based Complement Alternat Med. 2021;2021:3313419.
40. Guo S., Guo X., Zhang H. et al. The effect of diacerein on type 2 diabetic mellitus: a systematic review and meta-analysis of randomized controlled trials with trial sequential analysis. J Diabetes Res. 2020;2020:2593792. DOI: 10.1155/2020/2593792.
41. Piovesan F., Tres G.S., Moreira L.B. et al. Effect of diacerein on renal function and inflammatory cytokines in participants with type 2 diabetes mellitus and chronic kidney disease: a randomized controlled trial. PloS One. 2017;12(10):e0186554. DOI: 10.1371/journal.pone.0186554.
42. Major R.W., Cheng M.R.I., Grant RE.A. et al. Cardiovascular disease risk factors in chronic kidney disease: A systematic review and meta-analysis. PloS One. 2018;13(3):e0192895. DOI: 10.1371/journal.pone.0192895.
43. Anders H.J., Huber T.B., Isermann B. et al. CKD in diabetes: diabetic kidney disease versus nondiabetic kidney disease. Nat Rev Nephrol. 2018;14(6):361–377. DOI: 10.1038/s41581-018-0001-y.
44. Masclee G.M.C., Straatman H., Arfè A. et al. Risk of acute myocardial infarction during use of individual NSAIDs: a nested case-control study from the SOS project. PloS One. 2018;13(11):e0204746. DOI: 10.1371/journal.pone.0204746.
45. Наумов А.В., Алексеева Л.И. Ведение больных с остеоартритом и коморбидностью в общей врачебной практике. Клинические рекомендации. М.: Российское научное медицинское общество терапевтов; 2016. [Naumov A.V., Alekseeva L.I. Management of patients with osteoarthritis and comorbidity in general medical practice. Clinical guidelines. M.: Russian Scientific Medical Society of Therapists; 2016 (in Russ.)].
46. Каратеев А.Е., Насонов Е.Л., Ивашкин В.Т. и др. Рациональное использование нестероидных противовоспалительных препаратов. Клинические рекомендации. Научно-практическая ревматология. 2018;56:1–29. [Karateev A.E., Nasonov E.L., Ivashkin V.T. et al. Rational use of nonsteroidal anti-inflammatory drugs. clinical guidelines. Rheumatology Science and Practice. 2018;56:1–29 (in Russ.)]. DOI: 10.14412/1995-4484-2018-1-29.
47. Domper Arnal M.J., Hijos-Mallada G., Lanas A. Gastrointestinal and cardiovascular adverse events associated with NSAIDs. Expert Opin Drug Saf. 2022;21(3):373–384. DOI: 10.1080/14740338.2021.1965988.
48. Warner T.D., Giuliano F., Vojnovic I. et al. Nonsteroid drug selectivities for cyclo-oxygenase-1 rather than cyclo-oxygenase-2 are associated with human gastrointestinal toxicity: a full in vitro analysis. Proc Natl Acad Sci USA. 1999;96(13):7563–7568. DOI: 10.1073/pnas.96.13.7563.
49. Елисеева Л.Н., Бочарникова М.И., Бледнова А.Ю., Жихарева О.А. Актуальные вопросы выбора базисной терапии остеоартрита. РМЖ. 2021;10:36–40. [Eliseeva L.N., Bocharnikova M.I., Blednova A.Yu., Zhikhareva O.A. Topical issues concerning the choice of basic therapy for osteoarthritis. RMJ. 2021;10:36–40 (in Russ.)].
Авторы:
Клименко А.А.
Кондрашов А.А.
ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет), Москва, Россия
ГБУЗ «ГКБ № 1», Нальчик, Россия
Теги: остеоартрит
234567 Начало активности (дата): 08.09.2025
234567 Кем создан (ID): 989
234567 Ключевые слова: остеоартрит, коморбидность, симптом-модифицирующие препараты замедленного типа, нестероидные противовоспалительные препараты, диацереин, диартрин
12354567899
Похожие статьи
Опыт применения полика пролактона при производстве скаф фолда мениска коленного суставаРентген на дому 8 495 22 555 6 8
Русскоязычный перевод и адаптация опросника по оценке 4-летнего риска появления симптоматического остеоартрита коленных суставов
Роль матриксных металлопротеиназ в патогенезе остеоартрита
Идиопатическая подагра



