 05.12.2025
05.12.2025
Методология оценки ходьбы для выявления усталостных и декомпенсаторных механизмов работы опорно-двигательной системы у больных коксартрозом
Анализ походки является объективным инструментом оценки результатов лечения и функции костно-мышечной системы у пациентов с ортопедической патологией
ВВЕДЕНИЕ
Коксартроз представляет собой серьезную медико-социальную проблему, приводящую к стойким нарушениям ходьбы и значительному снижению качества жизни пациентов [1, 2]. В последние десятилетия отмечается устойчивый рост заболеваемости коксартрозом, что связано как с увеличением продолжительности жизни, так и с малоподвижным образом жизни [3]. Значительно расширяются показания к хирургическим методам лечения, количество которых неуклонно растет, что связано как с улучшением их безопасности, так и со спектром технических возможностей, влияющих на качество жизни и нейропсихологический статус пациентов [4, 5]. Прогрессивно возрастает число пациентов, нуждающихся в ревизионном эндопротезировании, прошедших первичное эндопротезирование 10-15 лет назад. При этом существующие подходы к диагностике, выбору оптимального момента для оперативного лечения и объективизации эффективности реабилитации данной категории больных остаются нестандартизированными.
Анализ походки на сегодняшний день является одним из наиболее корректных и объективных инструментов для оценки результатов лечения и интегральной характеристикой функции и активности для больных ортопедического профиля [6, 7, 8].
Современные исследования убедительно демонстрируют, что мультидисциплинарный подход к ведению пациентов с коксартрозом обеспечивает наиболее значимые клинические результаты [9, 10]. Однако его эффективность напрямую зависит от точности оценки индивидуальных компенсаторных возможностей опорно-двигательного аппарата и их воспроизводимости при многоцентровом мультидисциплинарном ведении каждого пациента. Особую сложность и в то же время востребованность представляет анализ биомеханических нарушений у больных коксартрозом с сочетанной патологией, особенно при наличии эндопротеза (ЭП) ТБС на контралатеральной конечности. Несмотря на имеющиеся публикации по анализу походки, клинические рекомендации (Объективная оценка функции ходьбы: клинические рекомендации и теоретические наработки основных биомеханических феноменов [11, 12], на сегодняшний день существует несколько краеугольных проблем:
— отсутствие единых стандартов проведения нагрузочных тестов;
— существенное влияние фактора усталости на результаты повторных измерений биомеханики ходьбы
— недостаточный учет роли смежных сегментов (таза, позвоночника, коленных суставов) в компенсации двигательного дефицита ТБС.
Особого внимания заслуживает вопрос о запасе прочности компенсаторных механизмов и возникновении усталостного компонента при повторных измерениях, который может существенно варьировать в зависимости от клинической ситуации. Традиционные методы оценки зачастую не позволяют количественно определить этот важнейший параметр, значимо влияющий на эффективность и объем медицинских вмешательств, на весь процесс восстановления пациента, его персонализированный биомеханический портрет и прогноз на восстановление [13].
Цель работы — разработать методологию оценки ходьбы для выявления усталостных и декомпенсаторных механизмов опорно-двигательной системы у больных коксартрозом, в том числе при наличии эндопротеза тазобедренного сустава на контралатеральной конечности.
Восстановление функции ходьбы, как ключевая цель ортопедических вмешательств, требует объективных критериев эффективности. Особую актуальность приобретает разработка технологий, обеспечивающих структурно-функциональное восстановление без формирования патологических двигательных компенсаций. Одним из возможных способов объективной оценки походки является внедрение в клиническую практику технологии инерциальных сенсоров.
Эта методика учитывает не только статические параметры, но и динамику изменения двигательных стереотипов под воздействием нагрузки, лечения и коррекции в режиме реального времени, что особенно важно для прогнозирования эффективности, своевременности и оптимальности объема лечебных и реабилитационных мероприятий. В этом случае использование инерциальных датчиков играет ключевую роль, позволяя выявлять особенности паттернов движения у пациентов с остеоартрозом ТБС и обеспечивая более точную оценку их функционального состояния [14, 15, 16].
МАТЕРИАЛ И МЕТОДЫ
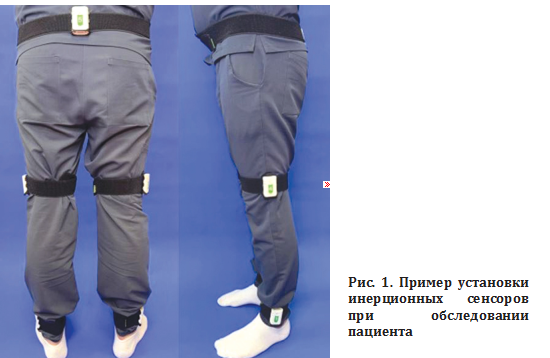
Исследование проводили с января по март 2025 г. на базе Клиники высоких медицинских технологий им. Н.И. Пирогова СПбГУ. Паттерн ходьбы оценивали с использованием тренажера «Стэдис-Стэп» с биологической обратной связью (ООО «Нейрософт», Иваново) в комплектации «Оценка» (РУ № РЗН 2018/7458 от 07.08.2018). Пять инерциальных сенсоров «Нейросенс» устанавливали на пояснично-крестцовый отдел позвоночника и на симметричные участки средней трети бедер и голеней на 2 см выше наружных лодыжек (рис. 1). Пациенту предлагали ходить по ровной поверхности в течение двух минут в удобном темпе.
Анализировали стандартные показатели, автоматически заносимые программой в протокол анализа ходьбы:
— временные параметры ходьбы (цикл шага (ЦШ), шаг, частота шага)
— фазы ходьбы (период опоры, одиночная опора, двойная опора, первая двойная опора, вторая двойная опоры, начало второй двойной опоры, период переноса);
— пространственные параметры ходьбы (высота подъема стопы, циркумдукция, — расстояние от центральной линии направления ходьбы до идентичных точек стопы во фронтальной плоскости, половина от базы шага);
— сгибание/разгибание в ТБС (амплитуда сгибания/разгибания, фаза максимального разгибания, максимальное разгибание, фаза максимального сгибания, максимальное сгибание);
— приведение/отведение в ТБС (амплитуда приведения/отведения, фаза максимального отведения, максимальное отведение, фаза максимального приведения, максимальное приведение);
— ротация в ТБС (амплитуда ротации, фаза максимальной наружной ротации, максимальная наружная ротация, фаза максимальной внутренней ротации, максимальная внутренняя ротация);
— кинематические параметры таза: приведение/отведение, сгибание/разгибание, ротация.
Учитывая значимость снижения опорной функции ТБС при развитии дегенеративных изменений в суставе, дополнительно проводили анализ гониограмм и кинематических параметров, синхронизированных с паттерном ходьбы ТБС (больной и интактной сторон) в периоде опоры (до 50 % ЦШ с шагом измерения в 5 % ).
В исследование включены пациенты (п = 41) с коксартрозом Ш-ГУ стадии, госпитализированные в травматолого-ортопедическое отделение для планового тотального ЭП ТБС. Обследование проводили перед операцией. Рентгенограммы выполняли на цифровом рентгеновском аппарате с автосшивкой изображений(Корея).
Критерии невключения: пациенты с острыми и/или хроническими заболеваниями различной этиологии в стадии обострения.
В рамках исследования проведено сплошное проспективное обследование пациентов, поступивших на эндопротезирование ТБС, с использованием технологии объективной оценки функции ходьбы на базе инерциальных сенсоров. Для анализа особенностей биомеханики ходьбы у пациентов применяли методику интервального и непрерывного тестирования продолжительностью шесть минут, что позволило выявить наличие специфичных усталостных изменений в движении. В исследовании также оценивали влияние ЭП ТБС на показатели биомеханики при коксартрозе.
Пациенты разделены на две группы случайным образом. В группе 1 (п = 26) анализ ходьбы проведен тремя сериями со стандартным протоколом по две минуты с перерывом между тестами (отдыхом) не менее 20 минут. В группе 2 (п = 15) анализ ходьбы также осуществлен тремя сериями со стандартным протоколом по две минуты, общим временем обследования шесть минут, без перерыва между отдельными проходами.
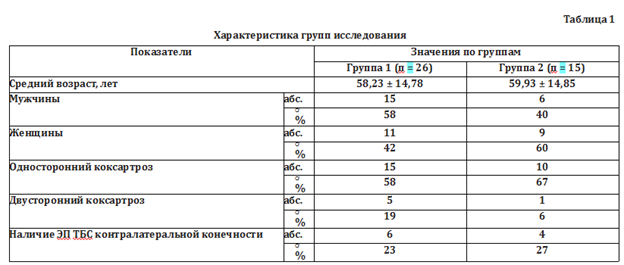
Группы были сопоставимы по половому и возрастному составу, что позволяет сравнивать полученные данные (табл. 1)
Статистическую обработку полученных данных выполняли с использованием программы BM SPSS Statistics v/23.0. Нормальность распределения полученных количественных данных определяли с использованием теста Шапиро - Уилка. Результаты показали, что все массивы данных соответствовали нормальному распределению, что позволило использовать параметры для дальнейшего анализа.
Достоверность различий оценивали с использованием критерия Стьюдента (для независимых и зависимых групп), корреляционных взаимосвязей между параметрами, — ранговой корреляции Спирмена.
Уровень достоверности принят а = 0,05.
Результаты представлены в виде М ± ст, где М- среднее арифметическое, ст — стандартное отклонение выборки.
Обследование проведено в соответствии с общепринятыми этическими принципами, нормами и правилами проведения научных исследований, регламентированными Хельсинской декларацией Всемирной медицинской ассоциации 1964 г., Федеральным законом № 323 «Об основах охраны здоровья граждан в Российской Федерации» от 21.11.2011, Федеральным законом № 152 «О персональных данных» от 27.07.2006.
РЕЗУЛЬТАТЫ
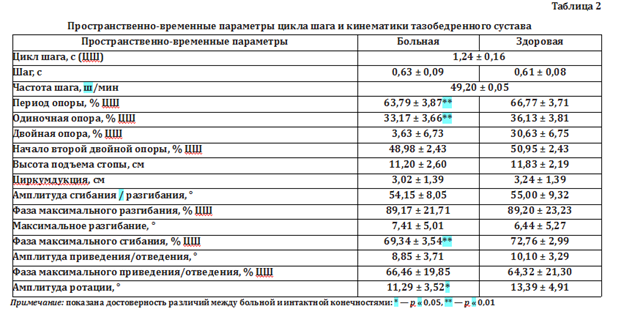
Пространственно-временные параметры ходьбы не продемонстрировали значимость различий по неопорным показателям всех пациентов исследования (табл. 2), что согласуется с ранее высказанным предположением о хорошем компенсаторном коридоре адаптации у пациентов травматолого-ортопедического профиля. В то же время определены значимые различия в периоде опоры за счет одиночной опоры, уменьшение ротации на стороне больного сустава и более ранняя фаза максимального сгибания, что в целом отражают механизмы компенсаторной разгрузки больной конечности для уменьшения опорной нагрузки на нее.
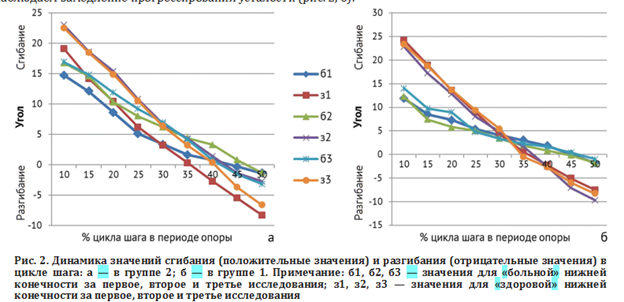
При анализе кинематических показателей сгибания/разгибания в ТБС в группе 2 (без интервала между исследованиями) значения сгибания на стороне коксартроза значимо снижаются от первого к третьему измерению, что указывает на прогрессирующую усталость или болевой синдром. Показатели на контралатеральной стороне, изначально более высокие, к третьему измерению также уменьшаются, что может быть проявлением компенсаторной перегрузки (рис. 2, а).
В группе 1 (интервальная ходьба с отдыхом) на больной стороне начальные значения сгибания выше, но к третьему измерению значения разгибания в тазобедренном суставе увеличиваются, что свидетельствует о неэффективности отдыха как восстановительного мероприятия для функции ходьбы в долгосрочной перспективе. На контралатеральной стороне снижение начальной амплитуды не сопровождается значительными усталостными проявлениями, аналогичными выявленным в предыдущей группе, то есть мы наблюдаем замедление прогрессирования усталости (рис. 2, б).
При анализе кинематического параметра приведение/отведение в группе 2 (без интервального отдыха) амплитуда на стороне больного сустава прогрессивно увеличивается (б1 = 3,70; б3 = 6,65; р < 0,05), что свидетельствует о компенсаторной гипермобильности. На здоровой стороне наблюдается снижение значений (з1 = 3,90; з3 = 1,65; р < 0,05), отражающее адаптационные механизмы для стабилизации походки (рис. 3, а).
В группе 1 (интервальный отдых) на больной стороне амплитуда движений увеличивается, возможно, за счет временного снижения интенсивности боли, тогда как на контралатеральной стороне мы наблюдаем снижение значений. Это может свидетельствовать о перераспределении нагрузки с целью симметризации паттерна ходьбы, что говорит об универсальном «правиле оптимума походки» при синергетическом взаимодействии мышц (рис. 3, б).
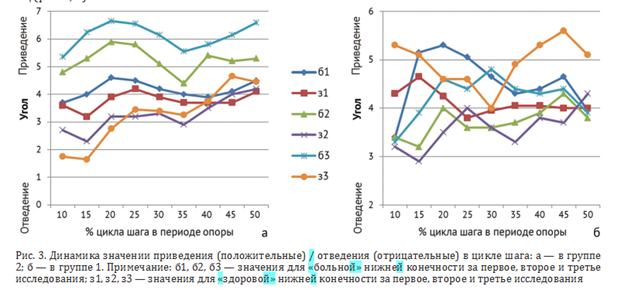
Таким образом, наличие интервального отдыха не позволяет выявить тонкие механизмы компенсации и усталостный вклад предельного напряжения при коксартрозе.
Для выявления усталостной декомпенсации мы сравнили в группе 2 (без интервального отдыха) параметры ходьбы отдельно у пациентов с ЭП ТБС на контралатеральной стороне (п = 4) и без него (п = 10) (табл. 3).
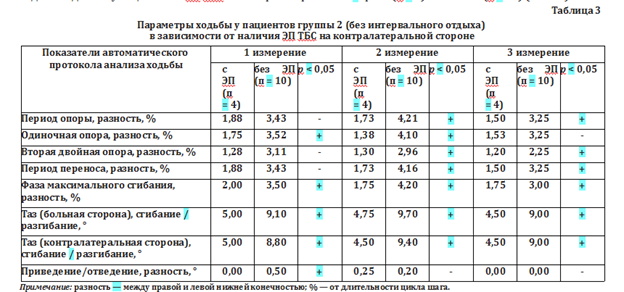
При анализе результатов обращает на себя внимание снижение периода опоры в подгруппе пациентов с ЭП ТБС, в то время как показатели сгибания/разгибания таза (вышележащий иерархический уровень компенсации) остаются стабильными, что указывает на более равномерное распределение нагрузки. Амплитуда приведения/отведения во время ходьбы остается неизменной, что говорит о стабильности движений.
У пациентов подгруппы без ЭП ТБС на контралатеральной конечности период опоры нарастает, а амплитуда сгибания/разгибания таза во время движения не изменяется, что может свидетельствовать о компенсаторной перегрузке опорно-двигательной системы при повторных нагрузках. Адаптивные паттерны проявляются в увеличении фазы максимального сгибания. Очевидно, что выявленные феномены являются проявлением системного характера коксартроза и ограниченными резервами компенсации со стороны контралатеральной конечности.
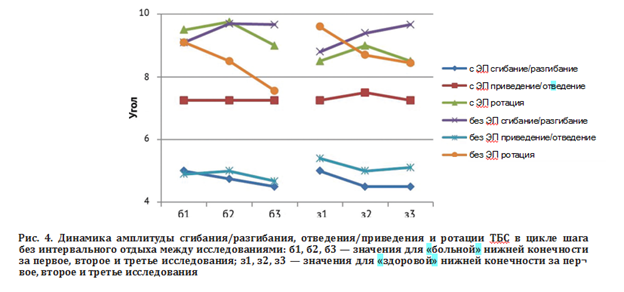
Дополнительно по результатам анализа ходьбы пациентов группы 2 (без интервального отдыха) проанализированы параметры сгибания/разгибания, отведения/приведения и ротации ТБС у пациентов с ЭП и без ЭП на контралатеральной конечности (рис. 4). При наличии ЭП на контралатеральной конечности имеются более низкие значения амплитуды сгибания/разгибания во время ходьбы.
ОБСУЖДЕНИЕ
Активное развитие и трансляция в клиническую практику новых методов лечения актуализируют необходимость поиска и применения инновационных средств объективной оценки результатов. С этой точки зрения визуализация динамики и объективный анализ функции ходьбы позволяет более точно оценить степень нарушений функции движения в динамике применения различных технологий консервативного и ортопедического лечения пациентов с остеоартритом ТБС, начиная с ранних стадий заболевания [17, 18].
Т. Шага полагают, что объективная оценка функции движения у пациентов с остеоартритом ТБС возможна без носимых датчиков с использованием только данных силовой платформы [14]. Такой подход — простой и быстрый, однако он ограничен только измерением реактивных сил и не позволяет получать информацию о кинематике движений в опорно-двигательной системе в целом, во всем многообразии включаемых компенсаторных механизмов, — в изменениях углов суставов, скоростях и траекториях движений конечностей, включениях вышележащих иерархических уровней. Использование же носимых датчиков дает возможность одновременно измерять кинематику и пространственно-временные параметры ходьбы, что обеспечивает более полное понимание паттернов походки и позволяет проводить точный анализ двигательных функций. Поэтому носимые/инерциальные датчики предпочтительнее для комплексной оценки двигательной активности.
Полученные результаты свидетельствуют о том, что анализ ходьбы с использованием технологии инерциальных сенсоров воспроизводим при многоцентровых исследованиях, а наличие отдыха между отдельными исследованиями не влияют на объективные биомеханические параметры паттерна ходьбы (отдых не меньше 20 мин). Воспроизводимость параметров ходьбы при использовании технологии инерциальных датчиков неоднократно доказана и в других исследованиях здоровых людей и пациентов с нарушениями мобильности [12, 19, 20]. Примененная в исследовании методология оценки ходьбы без интервального отдыха с тремя сериями анализа позволяет выявить ключевые особенности декомпенсаторных и усталостных механизмов у пациентов, страдающих коксартрозом. Использование нескольких инерциальных датчиков в сочетании с их правильным расположением — перспективный подход для распознавания состояний усталости и контроля безопасности движений [21]. В настоящее время уже существуют модели машинного обучения, которые помогают выявлять усталостные изменения в походке, например по данным реакции опоры у молодых здоровых людей при беге [22]. Но такие модели, обученные на небольших выборках и в узких условиях, не подойдут для пациентов с остеоартрозом ТБС, так как движения могут значительно отличаться. Для использования подобных моделей в клинике необходимы исследования на больших выборках с учетом всех входных параметров, то есть следует доработать и переобучить модели в группах именно таких пациентов.
Перспективность данного подхода подтверждается использованием машинного обучения для диагностики остеоартроза ТБС с помощью анализа параметров походки [23].
Уменьшение амплитуды движения в суставах при ходьбе без отдыха между измерениями указывает на нарастание усталостных компенсаторных процессов со стороны опорно-двигательной системы даже при кратковременных (шесть минут суммарно) нагрузках, достаточных для выявления истощения ресурсов организма и, в свою очередь, нуждающихся в компенсации. В исследовании при шестиминутном тесте ходьбы обнаружено «увеличение наклона туловища вперёд на стороне остеоартроза и двустороннее сокращение длины шага», связыванное с компенсаторными механизмами, обусловленными болью, при этом усталостные механизмы влияния авторы не упоминали [24]. Снижение скорости ходьбы также связывают исключительно с болью, не имея возможности оценить усталостный компонент [25]. Контралатеральная конечность с интактным суставом, являясь равноценной частью единой биомеханической цепи опорно-двигательной системы нижних конечностей, также вовлекается в процесс компенсации, что проявляется признаками функциональной перегрузки, при этом запускается «порочный круг», усиливающий асимметрию походки, что в свою очередь уменьшает эффективность самих компенсаторных механизмов. Работа с использованием оптоэлектронной системы также подтверждает наличие асимметрии походки и компенсаторных механизмов, что авторы связывают с болью в пораженном суставе и ограничением движений не только в больном ТБС, но и в ипсилатеральных коленном и голеностопных суставах [26]. Однако 8. Vап Коззот е! а1. при анализе походки во время ходьбы по лестнице у пациентов с остеоартрозом ТБС не наблюдают перегрузку контралатерального сустава и ипсилатерального коленного сустава, что свидетельствует о специфике компенсаторных стратегий в различных условиях и видах активностей [27]. Адаптация движений, связанная со страхом движений из-за боли, во время ходьбы может помочь пациентам снизить болевой синдром, однако приводит к перестройке всего паттерна за счет других уровней опорно-двигательной системы [27, 28]. К. Маегаша е! а1. свидетельствуют, что разница в длине нижних конечностей до 20 мм мало влияет на паттерны ходьбы, подтверждая наличие универсальных работающих компенсаторных механизмов при отсутствии выраженной деформации [29]. Компенсация при разности длины ног происходит из-за того, что укороченная нижняя конечность удлиняется за счет «большего разгибания в тазобедренном и коленном суставах, отведения бедра, подошвенного сгибания голеностопного сустава и меньшего приведения бедра», а другая нижняя конечность укорачивается «за счет более высокого сгибания в тазобедренном и коленном суставах, более высокого приведения бедра, дорсифлексии и более низкого приведения голеностопного сустава» [30].
Мы не обнаружили исследований, доказывающих влияние ЭП ТБС на усталостные механизмы при ходьбе. При этом в исследовании показано, что у пациентов с эндопротезом тазобедренного сустава, обладающих высокой функцией, достигается восстановление нормальной двигательной активности [31].
В нашем исследовании мы выявили, что при наличии ЭП на контралатеральной конечности значения амплитуды сгибания/разгибания во время ходьбы — более низкие, такие показатели отражают, скорее, стабилизацию биомеханики, ее стабильность, а не ухудшение функции. По нашему мнению, наличие ЭП ТБС на контралатеральной конечности ограничивает избыточные движения, предотвращая гипермобильность и перегрузку, как на больной, так и на здоровой сторонах при наличии ЭП ТБС без включения вышележащего уровня компенсации опорно-двигательной системы (пояснично-крестцовый отдел позвоночника). Если бы причиной сниженной амплитуды сгибания и разгибания во время ходьбы была неэффективная реабилитация, параметры амплитуды ротации и приведения/отведения также демонстрировали бы изменения, но, по нашим данным, они остаются стабильными.
Полученные результаты указывают на важность интеграции предложенной методологии динамической оценки ходьбы в клиническую практику для персонализации реабилитационных программ и ранней диагностики скрытых нарушений. Однако ограничения, связанные с объемом выборки, требуют дальнейших исследований с включением дополнительных методов оценки (опросники качества жизни, электромиография) при расширенной когорте пациентов.
Перспективным направлением является разработка алгоритмов прогнозирования декомпенсации на основе биомеханических маркеров и машинного обучения, что позволит оптимизировать лечение и улучшить качество жизни пациентов с коксартрозом.
ЗАКЛЮЧЕНИЕ
Выявлено, что наличие отдыха не менее 20 минут между отдельными сериями исследования ходьбы достаточно для воспроизведения исходных данных параметров ходьбы, что может быть использовано при многоцентровом мультидисциплинарном сопровождении пациентов.В группе непрерывной ходьбы получены достоверные различия в динамике сгибания/разгибания в ТБС на здоровой стороне, значимо увеличивающиеся от первого к третьему измерению до 35 % цикла шага, и от первого ко второму — до 45 % цикла шага. Аналогичные результаты проявления усталостного компонента в группе пациентов с отдыхом между сериями проходов получены не были. Таким образом, анализ непрерывной ходьбы в большей степени выявляет напряжение компенсации опорнодвигательной системы для достижения оптимума, тогда как для больной конечности обеспечивается режим наилучшего функционирования за счет большего нагружения здоровой.
Определено, что у пациента, страдающего односторонним коксартрозом, наличие эндопротеза ТБС на контралатеральной конечности значимо влияет на паттерн ходьбы: при наличии ЭП зарегистрированы более низкие значения амплитуды сгибания/разгибания ТБС, что ограничивает избыточные движения, предотвращая гипермобильность и перегрузку как на больной, так и на здоровой сторонах.
СПИСОК ИСТОЧНИКОВ
1. Boekesteijn RJ, Smolders JMH, Busch VJJF, et al. Independent and sensitive gait parameters for objective evaluation in knee and hip osteoarthritis using wearable sensors. BMC Musculoskelet Disord. 2021;22(1):242
2. Costa D, Lopes DG, Cruz EB, et al. Trajectories of physical function and quality of life in people with osteoarthritis: results from a 10-year population-based cohort. BMC Public Health. 2023;23(1):1407. doi: 10.1186/s12889-023-16167-9.
3. GBD 2021 Osteoarthritis Collaborators. Global, regional, and national burden of osteoarthritis, 1990-2020 and projections to 2050: a systematic analysis for the Global Burden of Disease Study 2021. Lancet Rheumatol. 2023;5(9):e508-e522.
4. Джигкаев А.Х., Тынтерова А.М., Козенков И.И. и др. Клинико-функциональный и нейропсихологический статус пациентов, поступивших на эндопротезирование суставов. Гений ортопедии. 2024;30(5):659-669.
5. Удинцева М.Ю., Волокитина Е.А., Колотыгин Д.А., Кутепов С.М. Первичное и ревизионное эндопротезирование тазобедренного сустава с восполнением дефектов вертлужной впадины. Гений ортопедии. 2024;30(6):797-810.
6. Rivera RJ, Karasavvidis T, Pagan C, et al. Functional assessment in patients undergoing total hip arthroplasty. Bone Joint J. 2024;106-B(8):764-774. doi: 10.1302/0301-620X.106B8.BJJ-2024-0142.R1.
7. Bahadori S, Middleton RG, Wainwright TW. Using Gait Analysis to Evaluate Hip Replacement Outcomes-Its Current Use, and Proposed Future Importance: A Narrative Review. Healthcare (Basel). 2022;10(10):2018.
8. Королева С.В. Технология объективной оценки двигательных нарушений в динамике реабилитации у больных травматолого-ортопедического профиля. Физическая и реабилитационная медицина. 2022;4(1):47-52.
9. Moseng T, Vliet Vlieland TPM, Battista S, et al. EULAR recommendations for the non-pharmacological core management of hip and knee osteoarthritis: 2023 update. Ann Rheum Dis. 2024;83(6):730-740. doi: 10.1136/ard-2023-225041.
10. Павлов В.В., Мушкачев Е.А., Тургунов Э.Н. и др. Альтернативный способ измерения параметров сагиттального баланса у пациентов в положении сидя и стоя. Гений ортопедии. 2024;30(3):362-371.
11. Скворцов Д.В. Диагностика двигательной патологии инструментальными методами: анализ походки, стабилометрия. М.: Науч.-мед. фирма МБН; 2007:617.
12. Скворцов Д.В., Королева С.В. Динамика параметров ходьбы в процессе реабилитации после тотального эндопротезирования коленного сустава. Научно-практическая ревматология. 2019;57(6):704-707.
13. Kobsar D, Masood Z, Khan H, et al. Wearable Inertial Sensors for Gait Analysis in Adults with Osteoarthritis-A Scoping Review. Sensors (Basel). 2020;20(24):7143. doi: 10.3390/s20247143.
14. Ibara T, Anan M, Karashima R, et al. Coordination Pattern of the Thigh, Pelvic, and Lumbar Movements during the Gait of Patients with Hip Osteoarthritis. J Healthc Eng. 2020;2020:9545825. doi: 10.1155/2020/9545825.
15. Ismailidis P, Nüesch C, Kaufmann M, et al. Measuring gait kinematics in patients with severe hip osteoarthritis using wearable sensors. Gait Posture. 2020;81:49-55. doi: 10.1016/j.gaitpost.2020.07.004.
16. Ismailidis P, Kaufmann M, Clauss M, et al. Kinematic changes in severe hip osteoarthritis measured at matched gait speeds. J Orthop Res. 2021;39(6):1253-1261. doi: 10.1002/jor.24858.
17. Homma D, Minato I, Imai N, et al. Three-dimensional evaluation of abnormal gait in patients with hip osteoarthritis. Acta Med Okayama. 2020;74(5):391-399. doi: 10.18926/AMO/60798.
18. Ghaffari A, Clasen PD, Boel RV, et al. Multivariable model for gait pattern differentiation in elderly patients with hip and knee osteoarthritis: A wearable sensor approach. Heliyon. 2024;10(17):e36825. doi: 10.1016/j.heliyon.2024.e36825.
19. Kobsar D, Charlton JM, Tse CTF, et al. Validity and reliability of wearable inertial sensors in healthy adult walking: a systematic review and meta-analysis. J Neuroeng Rehabil. 2020;17(1):62. doi: 10.1186/s12984-020-00685-3.
20. Rast FM, Labruyère R. Systematic review on the application of wearable inertial sensors to quantify everyday life motor activity in people with mobility impairments. J Neuroeng Rehabil. 2020;17(1):148. doi: 10.1186/s12984-020-00779-y.
21. Lee YJ, Wei MY, Chen YJ. Multiple inertial measurement unit combination and location for recognizing general, fatigue, and simulated-fatigue gait. Gait Posture. 2022;96:330-337. doi: 10.1016/j.gaitpost.2022.06.011.
22. Gao Z, Zhu Y, Fang Y, et al. Automated recognition of asymmetric gait and fatigue gait using ground reaction force data. Front Physiol. 2023;14:1159668. doi: 10.3389/fphys.2023.1159668.
23. Ghidotti A, Regazzoni D, Rizzi C, et al. Applying Machine Learning to Gait Analysis Data for Hip Osteoarthritis Diagnosis. Stud Health Technol Inform. 2025;324:152-157. doi: 10.3233/SHTI250178.
24. Davis-Wilson H, Hoffman R, Cheuy V, et al. Gait compensations, pain, and functional performance during the six minute walk test in individuals with unilateral hip osteoarthritis. Clin Biomech (Bristol). 2024;120:106366.
25. Ritsuno Y, Morita M, Mukaino M, et al. Determinants of gait parameters in patients with severe hip osteoarthritis. Arch Phys Med Rehabil. 2024;105(2):343-351. doi: 10.1016/j.apmr.2023.08.021.
26. Hulet C, Hurwitz DE, Andriacchi TP, et al. Functional gait adaptations in patients with painful hip. Rev Chir Orthop Reparatrice Appar Mot. 2000;86(6):581-9. (In French)
27. Van Rossom S, Emmerzaal J, van der Straaten R, et al. The biomechanical fingerprint of hip and knee osteoarthritis patients during activities of daily living. Clin Biomech (Bristol). 2023;101:105858. doi: 10.1016/j.clinbiomech.2022.105858.
28. Aydemir B, Huang CH, Foucher KC. Gait speed and kinesiophobia explain physical activity level in adults with osteoarthritis: A cross- sectional study. J Orthop Res. 2023;41(12):2629-2637. doi: 10.1002/jor.25624.
29. Maezawa K, Nozawa M, Gomi M, et al. Effect of limited range of motion of the hip joint and leg-length discrepancy on gait trajectory: an experiment to reproduce the asymmetric gait that occurs in patients with osteoarthritis of the hip joint. Hip Int.2023;33(4):590-597. doi: 10.1177/11207000221102849.
30. Siebers HL, Eschweiler J, Quack VM, et al. Inertial measurement units for the detection of the effects of simulated leg length inequalities. J Orthop Surg Res. 2021;16(1):142. doi: 10.1186/s13018-021-02212-z.
Информация об авторах:
Светлана Валерьевна Королева — доктор медицинских наук, профессор кафедры
Анжела Сергеевна Мулык — врач — травматолог-ортопед
Теги: оксартроз
234567 Начало активности (дата): 05.12.2025
234567 Кем создан (ID): 989
234567 Ключевые слова: анализ походки, декомпенсаторные реакции, усталость, коксартроз, методология, Стэдис
12354567899
Похожие статьи
Остеоартроз коленного суставаРентген на дому 8 495 22 555 6 8
Переходные пояснично-крестцовые позвонки: распространенность различных типов и подтипов патологии (обзор литературы)
Артроскопия тазобедренного сустава
Пациент-связанные факторы риска осложнений после первичных эндопротезирований тазобедренного сустава и ревизионных вмешательств



